
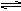 2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( )
2Z,当达到化学平衡时,反应物总物质的量与生成物总物质的量相等,此时x的转化率是( ) | A.70% | B.60% | C.50% | D.40% |
科目:高中化学 来源:不详 题型:单选题
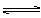 cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是
cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是 | A.a+b>c+d |
| B.重新达到平衡时A的转化率增大 |
| C.平衡向右移动 |
| D.重新达到平衡时D的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
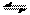 (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
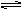 PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是( )
PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是( )| A.m+n>p | B.m+n<p | C.m<p | D.m>P |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
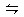 xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为( )
xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
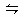 3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )
3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煅烧粉碎的硫铁矿利于SO2的生成 |
B.对2HI(g)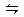 I2(g)+H2(g),增大压强可使平衡体系颜色变深 I2(g)+H2(g),增大压强可使平衡体系颜色变深 |
C.反应NO2+CO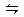 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应:N2+3H2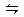 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应混合物的浓度 | B.反应物的转化率 |
| C.正、逆反应速率 | D.体系的压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com