
分析 (1)依据热化学方程式和盖斯定律计算得到,a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1,由盖斯定律b×2-a得到;
(2)依据化学平衡移动原理和影响因素分析判断,2NO2=N2O4,反应是气体体积减小的放热反应.
解答 解:(1)a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
由盖斯定律b×2-a得到 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol;
(2)四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮,由二氧化氮制取四氧化二氮,2NO2=N2O4,反应是放热反应,反应前后气体体积减小所以反应条件为:增大压强、降温都有利于反应正向进行;
故答案为:增大压强、降温.
点评 本题考查了盖斯定律的计算应用,化学平衡的影响因素分析判断,注意平衡移动原理的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO2、NH3、BF3中,所有原子都满足最外层8电子的稳定结构 | |
| B. | 在元素周期表中金属和非金属交界处可以找到半导体材料 | |
| C. | 由非金属元素组成的化合物一定是共价化合物 | |
| D. | 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 | |
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 | |
| C. | 乙醇脱水制乙烯;溴乙烷与NaOH乙醇溶液共热制乙烯 | |
| D. | 苯的硝化;苯与氢气(镍作催化剂)制取环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2→H2CO3 | B. | SiO2→Na2SiO3 | C. | SiO2→H2SiO3 | D. | Na2O2→Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能增加单位体积内活化分子的百分数和活化分子总数使反应速率增大 | |
| D. | 缩小容器的体积而增大压强,可增加活化分子总数,从而使反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 日常生活中无水乙醇常用于杀菌消毒 | |
| C. | 丁达尔效应是区分胶体和溶液的一种常用物理方法 | |
| D. | 加铁酱油就是在酱油中加入了纳米级别的铁粉,是我国的补铁工程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
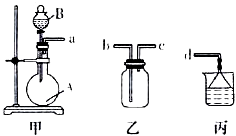 熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题:
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题: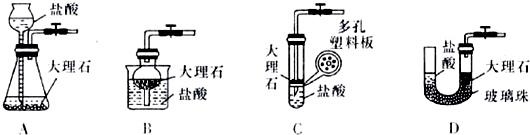
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com