
����Ŀ����14�֣���ҵ�Ͽ��Բ����Ȼ�ԭ���Ʊ�����þ��þ�е�Ϊ1107�����۵���648.8������
��1������ʽ̼��þ[4MgCO3��Mg(OH)2��5H2O]�ͽ�̿��һ��������ϣ�������չ�ʽ¯����������500������һ��ʱ�䣬Ȼ��������1450����Ӧ�Ƶ�þ��
����̼��ԭ���Ʊ�����þ��Ҫ������ж����ڿ����н��У���ԭ���� ��
����̿���ʽ̼��þ�����ʵ����ı�ֵ��ͬ��þ�Ļ�ԭ���нϴ�Ӱ�죬�����ͼ������ֵ����15��1ʱ����ԭ���½���ԭ������� ��
����ʽ̼��þ�ֽ���ͼ��ʾ��д����1450����Ӧ�Ƶ�þ�Ļ�ѧ��Ӧ����ʽ ��


��2����ҵ�Ͽ��Բ���MgCl2��Һ��Na2CO3��Һ����Ʊ���ʽ̼��þ��д����Ӧ���ӷ���ʽ ��
��Ӧ����68�����¶Ȳ��˸���68����ԭ���� ��
��3����ҵ���õ��MgCl2��Һ����Mg(OH)2����ͼ��Ȼ����Mg(OH)2����Һ���������еĶ�����̼�����ٶ�����̼���ŷ�ͬʱ������ʽ̼��þ���õ�ص������缫��ӦʽΪ �����ʱ���õ�������Ϊ ��

���𰸡�ÿ��2��
��1�����ڿ�����þ����������
�������Ľ�̿������þ�������ռ�����þ������
��MgO+C = Mg+CO
��2��5Mg2++5CO32-+ H2O = 4MgCO3��Mg(OH)2 ��+ CO2�� ��ʽ̼��þ���ȷֽ��ˮ��Ϊ������þ
��3��Mg2+ + 2H2O +2e- = Mg(OH)2��+H2�� HCl
��������
���������
��1��������þ���ʻ��ã��ڿ��������������͵����ȷ�Ӧ������Ҫ�ų�������Ӧ��������ֵ����15��1ʱ���ǽ�̿��������̿���нϴ�ı���������������ã�������þ��������þ�IJ��ʽ��ͣ�������ͼ������ȷ���ֽ�����ղ���Ϊ����þ��5��40/484=0.41������Ϊ��̿���������Բ���Ϊþ��CO��
��2���÷�ӦΪþ���Ӳ���ˮ��õ��IJ��5Mg2++5CO32-+ H2O = 4MgCO3��Mg(OH)2 ��+ CO2������ʽ̼��þ���ȷֽ�Ϊ����þ��ˮ��Ϊ������þ��һ���ֽ�Ϊ����þ����3�����ʱ���������ӷŵ磬ӦΪ�����ӷŵ������������Һ�����ɵ�������������þ���ӷ�Ӧ����������þ�����������������ŵ���������ӣ�������ͨ�������ӽ���Ĥ�������������õ����ḱ��Ʒ��


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�м������ۻ�������������и��������ڸ���Һ���ܴ����������
A. Fe3+��NO3-��K+��Na+ B. Cu2+��OH-��SO42-��Cl-
C. Ba2+��CO32-��OH-��K+ D. Na+��NH4+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ��ȥ������������HCl��H2O����ʹ��������ͨ���� ��
A. ����ʳ��ˮ��Ũ���� B. NaOH��Һ��Ũ����
C. NaHCO3��Һ���轺 D. Ũ���ᡢ��ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AlCl3��һ�ִ�����ijУѧϰС��������װ���Ʊ�����AlCl3����֪��AlCl3���������е�ˮ����ʱ�ܾ��ҷ�Ӧ����Al(OH)3��HCl��AlCl3��180��ʱ����������Ҫ������������⣺

��1��a����������Ϊ_______��Aװ���з�Ӧ�Ļ�ѧ����ʽΪ_______��
��2���Լ�bΪ_______��Cװ�õ�����Ϊ_______��
��3������d���ܽϴֵ�ԭ����_______��Eװ�õ�����Ϊ_______��
��4��Fװ�õ�����Ϊ_______��
��5������ͼ�е�D��Eװ�ø�Ϊ����װ�ã�Dװ���е�����Ϊ_______�������ӷ���ʽ��ʾE�е�����仯_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ���У���̬ԭ����δ�ɶԵ�������������������ͬ��Ԫ���м���
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ1.0mol/L��HX��Һ��HY��Һ��HY�� NaY�Ļ����Һ���ֱ��ˮϡ�ͣ�ϡ�ͺ���Һ��pH��Ũ�ȵı仯��ͼ��ʾ������������ȷ���ǣ� ��
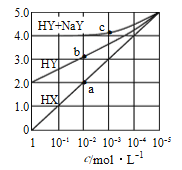
A. HX��ǿ�ᣬ��Һÿϡ��10����pHʼ������1
B. ������HY�ĵ��볣��Ϊ1.0��10-4
C. ��Һ��ˮ�ĵ���̶ȣ�a�����b��
D. c ����Һ�У�c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16�֣�����Ϊ��ҵ�Ӻ�ˮ����ȡҺ�������ͼ��

��֪����ķе�Ϊ59��������ˮ���ж��ԡ���ش�
��1��ijͬѧ������ͼ1��װ�ý��в���������������ʵ�飬�����в�����ʱ��Ӧ�رջ��� ������ ��

��2���������пɸ��� �����ж��ȿ���������
��3���������м��жϷ�Ӧ��ȫ�������� ��
��4���ӡ���ˮ���������������ˮ�����������Ŀ���� ��
��5���������á�ͼ2��װ�ý�������������ƿ����δ��װ�¶ȼƣ���װ��λ��ʱӦע�� װ��C��ֱ�Ӽ��Ȳ�������Ӧ��Ϊ ������ʱ����ˮӦ�� �˽��루�e����f������ͼ��E��F�������� �� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���2 L�ܱ������ڣ���Ӧ2NO2(g)![]() N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
��1����NO2��ʾ0��2 s�ڸ÷�Ӧ��ƽ���ٶ�___________���ڵ�5 sʱ��NO2��ת����Ϊ_____�������ϱ����Կ��������ŷ�Ӧ���У���Ӧ������С����ԭ����_____________________��
��2��������Ӧ�ڵ�3 s��ﵽƽ�⣬��˵���÷�Ӧ�Ѵﵽƽ��״̬����______��
a����λʱ���ڣ�����2 mol NO2��ͬʱ����1 mol��N2O4
b��������ѹǿ���ֲ���
c��v��(NO2)��2v��(N2O4)
d���������ܶȱ��ֲ���
��3����2 s�ڣ��÷�Ӧ_______�������ա��ų����� _______������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�����ӷ���ʽ��ȷ����
A. ������̼������Һ��Ӧ��2H++CO32��=CO2��+H2O
B. ��ȩ����������Cu��OH��2��Һ��Ӧ��HCHO+2Cu(OH)2 ![]() HCOOH+Cu2O��+2H2O
HCOOH+Cu2O��+2H2O
C. ʵ������Һ��ͱ��ڴ������������屽��![]()
D. ��CO2ͨ�뱽������Һ��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com