

分析 分析转化关系可知红褐色沉淀F为Fe(OH)3,白色沉淀E为Fe(OH)2,G溶液时氢氧化铁和盐酸反应市场的氯化铁溶液,D溶液中加入硝酸和硝酸银出现白色沉淀H为AgCl,证明D中含氯离子溶液焰色反应透过钴玻璃为紫色,证明溶液中含钾元素,则D为KCl,C溶液为KOH溶液,B为FeCl2溶液,G溶液氯化铁溶液和A为铁发生反应生成氯化亚铁,则A为Fe,A和盐酸反应生成氯化亚铁和氢气,据此分析回答问题.
解答 解:分析转化关系可知红褐色沉淀F为Fe(OH)3,白色沉淀E为Fe(OH)2,G溶液时氢氧化铁和盐酸反应市场的氯化铁溶液,D溶液中加入硝酸和硝酸银出现白色沉淀H为AgCl,证明D中含氯离子溶液焰色反应透过钴玻璃为紫色,证明溶液中含钾元素,则D为KCl,C溶液为KOH溶液,B为FeCl2溶液,G溶液氯化铁溶液和A为铁发生反应生成氯化亚铁,则A为Fe,A和盐酸反应生成氯化亚铁和氢气,
(1)分析可知B为FeCl2,D为KCl,故答案为:FeCl2;KCl;
(2)E转变成F的反应为氢氧化亚铁被氧气氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向G溶液加入A的反应为铁和氯化铁反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查了物质转化关系、物质性质分析判断,主要是铁极其化合物性质的理解应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3和NaHCO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| B. | 等物质的量的氢氧根离子(OH-)与羟基(-OH)所含电子数相等 | |
| C. | 常温常压下28 g CO与22.4 L O2所含分子数相等 | |
| D. | 16 g CH4与18 g NH4+所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
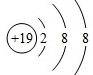 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
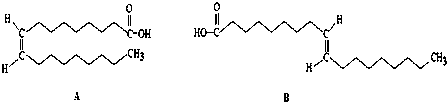
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com