
【题目】下列实验操作能达到实验目的的是( )
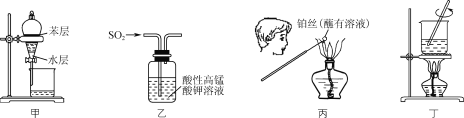
A.用装置甲从碘水中萃取碘B.用装置乙验证SO2的漂白性
C.用装置丙检验溶液中是否有K+D.用装置丁将FeCl3溶液蒸干制备FeCl3
【答案】A
【解析】
A. 苯与水不互溶,与碘不反应,且I2在苯中的溶解度远大于在水中的溶解度,因此可用苯作萃取剂,萃取碘水中的I2,可以达到实验目的,A项正确;
B. SO2与酸性的高锰酸钾之间因发生氧化还原反应而使高锰酸钾溶液褪色,因此不能证明SO2具有漂白性,不能达到实验目的,B项错误;
C. 用焰色反应检验K+时,观察火焰的颜色时要透过蓝色的钴玻璃,不能达到实验目的,C项错误;
D. 将FeCl3溶液蒸干的过程中,Fe3+水解生成Fe(OH)3,加热后生成Fe2O3,因此将FeCl3溶液蒸干不能制备纯净的FeCl3,不能达到实验目的,D项错误;
答案选A。
原物质 | 蒸干灼烧后固体物质 |
Ca(HCO3)2 | CaCO3或CaO |
NaHCO3 | Na2CO3 |
KMnO4 | K2MnO4和MnO2 |
NH4Cl | 分解为NH3和HCl无固体物质存在 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列事实与所对应的离子方程式正确的是
A. 室温下,测定醋酸钠溶液的pH > 7:CH3COONa === CH3COO-+Na+
B. 实验室用氯化铝溶液和氨水制备氢氧化铝:Al3+ +3OH- === Al(OH)3↓
C. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3 + 2H+ === SO2 ↑ + S↓+ 2Na+ + H2O
D. 用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s) + CO32-(aq) === CaCO3(s) + SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.由水电离出的c(H+)=10-13molL-1的溶液:K+、Ba2+、Cl-、CO32-
B.使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+
C.常温下![]() =1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
D.0.1molL-1盐酸的澄清透明溶液中:Fe3+、K+、SO42-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:

已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。

(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子的结构、性质及用途如表所示:
元素 | 结构、性质及用途 |
A | A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体 |
B | B元素的一种核素可用于考古时测定一些文物的年代 |
C | C 原子最外层电子总数是次外层电子总数的3倍 |
D | D 原子的2p能级处于半充满状态 |
E | E的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
(1)A元素基态原子的电子排布式为_______。
(2)B、C、D元素的第一电离能由大到小的顺序为______(填元素符号)。
(3)简单气态氢化物的热稳定性:C ____E(填“>”或“<”)。
(4)根据VSEPR模型预测D的氢化物的立体构型为______,中心原子D的杂化轨道类型为____;BD-中σ键与π键的数目之比为_________。
(5)足量D的氢化物水溶液与CuSO4溶液反应生成深蓝色的配离子,该配离子用结构示意图表示为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )
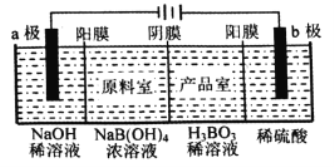
A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中可以提取镁、溴等产品。某兴趣小组以MgBr2为原料,模拟从海水中制备溴和镁。下列说法错误的是( )
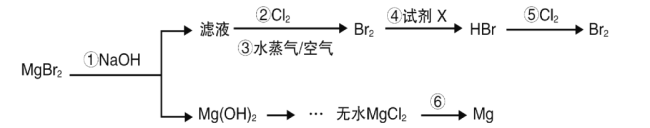
A.工业上步骤①常用Ca(OH)2代替NaOH
B.设计步骤②、③、④的目的是为了富集溴
C.步骤④中试剂X可选用饱和二氧化硫水溶液
D.工业上实现步骤⑥,通常用氢气还原氯化镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com