
【题目】已知![]() 是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中
是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中![]() 、
、![]() 、
、![]() 的组成百分率与pH的关系如图所示,下列说法正确的是( )
的组成百分率与pH的关系如图所示,下列说法正确的是( )
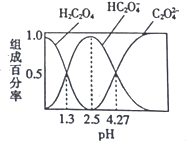
A.![]() 的溶液中:
的溶液中:![]()
B.反应![]() 的平衡常数为
的平衡常数为![]()
C.向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D.![]() 的溶液中:
的溶液中:![]()
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是

A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
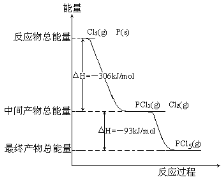
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式___。
(2)PCl5分解成PCl3和Cl2的热化学方程式___。
(3)P和Cl2分两步反应生成1molPCl5的△H3=__,P和Cl2一步反应生成1molPCl5的△H4___△H3 (填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,已知反应前后各元素化合价不变,其化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是_______________。
Ⅱ.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)—空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
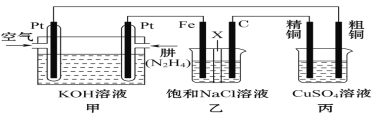
根据要求回答相关问题:
(2)甲装置中通入_________气体的一极为正极,负极的电极反应式为__________。
(3)乙装置中石墨电极为______极,其电极反应式为___________;可以用______________检验该反应产物,电解一段时间后,乙池中的溶液呈__________性。
(4)图中用丙装置模拟工业中的_____________________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为____________g。
(5)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.0100mol·L-1的NaOH溶液滴入浓度为0.0100mol·L-1,体积为20.00mL的CH3COOH溶液.在滴加过程中n(CH3COOH)和n(CH3COO-)随溶液pH的分布关系如图。下列说法不正确的是( )
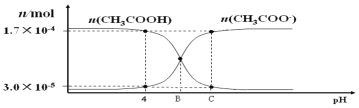
A.pH=4时,醋酸的电离常数Ka≈1.8×10-5
B.B点时,c(CH3COOˉ)=c(CH3COOH)
C.B点时,在溶液中滴入酚酞试剂,溶液显红色
D.C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:![]()
![]()
![]() 。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出该反应的平衡常数表达式_______________。
(2)前2s内的平均反应速率![]() __________;达到平衡时,CO的转化率为__________。
__________;达到平衡时,CO的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com