
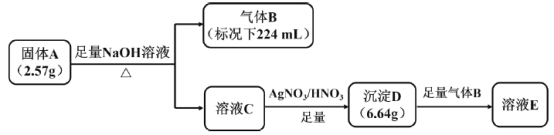
【题目】I.橙红色化合物A由五种元素组成,其中一种元素为原子半径最大的短周期元素(稀有气体元素除外),按如图流程进行实验。气体B为纯净物,能使湿润的红色石蕊试纸变蓝,溶液C呈黄色,沉淀D为砖红色沉淀。
请回答:
(1)组成A的金属元素是___________(填元素符号),A的化学式是___________。
(2)沉淀D与足量B反应的离子反应方程式____________。
(3)A中的某种金属元素对应的单质可以通过铝热反应制备,写出化学反应方程式________。
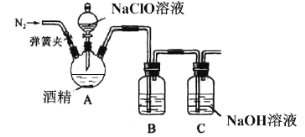
II.某兴趣小组为了探究84消毒液(主要成分NaClO)和酒精混合使用是否存在安全隐患,利用如图装置进行实验。
请回答:
(1)三颈烧瓶中出现黄绿色气体,请写出相应的化学方程式__________。(乙醇被氧化为乙醛)
(2)有同学用手触碰三颈烧瓶后发现,反应一段时间后装置温度升高,所以提出产生的气体中可能混有O2,请用离子方程式解释__________,该同学为了验证O2,打开弹簧夹,用带火星的木条检验,该操作的错误为___________。
【答案】Na 、Cr NH4NaCr2O7 Ag2CrO4+4NH3=2Ag(NH3)2++CrO42- Cr2O3+2Al![]() Al2O3+2Cr 2NaClO+C2H5OH→2NaOH+CH3CHO+Cl2↑ 2ClO-=O2+2Cl- 乙醇易挥发且易燃,与带火星木条存在安全隐患
Al2O3+2Cr 2NaClO+C2H5OH→2NaOH+CH3CHO+Cl2↑ 2ClO-=O2+2Cl- 乙醇易挥发且易燃,与带火星木条存在安全隐患
【解析】
I.根据流程短周期中原子半径最大的是金属钠,和氢氧化钠反应,生成能使湿润的红色石蕊试纸变蓝的气体,说明有NH4+;A为橙红色化合物且由五种元素组成,A与足量NaOH反应得到的溶液C呈黄色,溶液C与AgNO3/HNO3反应得到的沉淀D为砖红色沉淀,说明C含CrO42-,可知A中还含有Cr2O72-,沉淀D是Ag2CrO4;结合数据计算分析。
II.84消毒液具有强氧化性,酒精具有还原性,会发生氧化还原反应,产生的黄绿色气体是氯气,次氯酸根不稳定,易分解成氧气和氯离子。
I.(1)根据流程短周期中原子半径最大的是金属钠,和氢氧化钠反应,生成能使湿润的红色石蕊试纸变蓝的气体,说明有NH4+;A为橙红色化合物且由五种元素组成,A与足量NaOH反应得到的溶液C呈黄色,溶液C与AgNO3/HNO3反应得到的沉淀D为砖红色沉淀,说明C含CrO42-,可知A中还含有Cr2O72-,沉淀D是Ag2CrO4;组成A的金属元素是Na和Cr;根据N守恒,n(NH4+)=n(NH3)=0.224L÷22.4L/mol=0.01mol,根据Cr守恒,n(Cr2O72-)=![]() n(Ag2CrO4)=
n(Ag2CrO4)=![]() ×
×![]() =0.01mol,则n(Na+)=
=0.01mol,则n(Na+)=![]() =0.01mol,n(Na+):n(NH4+):n(Cr2O72-)=1:1:1,则A的化学式是NH4NaCr2O7,故本题答案:Na 、Cr;NH4NaCr2O7。
=0.01mol,n(Na+):n(NH4+):n(Cr2O72-)=1:1:1,则A的化学式是NH4NaCr2O7,故本题答案:Na 、Cr;NH4NaCr2O7。
(2)沉淀D是Ag2CrO4,和足量的氨气反应,沉淀溶解,发生的反应是:Ag2CrO4+4NH3=2Ag(NH3)2++CrO42-,故本题答案为:Ag2CrO4+4NH3=2Ag(NH3)2++CrO42-。
(3)铝热反应是利用铝的还原性制备高熔点、还原性比Al弱的金属,可制备金属铬,化学反应方程式为:Cr2O3+2Al![]() Al2O3+2Cr,故本题答案为:Cr2O3+2Al
Al2O3+2Cr,故本题答案为:Cr2O3+2Al![]() Al2O3+2Cr。
Al2O3+2Cr。
II.(1)84消毒液具有强氧化性,酒精具有还原性,会发生氧化还原反应,乙醇被氧化成乙醛,黄绿色气体是氯气,根据得失电子守恒、原子守恒,反应的化学方程式为2NaClO+C2H5OH→2NaOH+CH3CHO+Cl2↑,故本题答案为:2NaClO+C2H5OH→2NaOH+CH3CHO+Cl2↑。
(2)反应一段时间后装置温度升高,次氯酸根分解,有O2产生,离子方程式为2ClO-=O2+2Cl-;乙醇易挥发且易燃,所得气体中混有乙醇蒸气,用带火星的木条检验存在安全隐患,故本题答案为:2ClO-=O2+2Cl-;乙醇易挥发且易燃,与带火星木条存在安全隐患。


科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
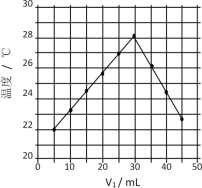
A.做该实验时环境温度低于22℃
B.该实验表明化学能可能转化为热能
C.该实验表明有水生成的反应一定是放热反应
D.NaOH溶液的浓度约为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶多酚具有抗氧化作用和抗衰老、降血脂等一系列很好的药理功能,其结构简式如下图,关于茶多酚的下列说法正确的数目有( )

①1mol茶多酚与浓溴水发生加成反应最多消耗6molBr2
②1mol茶多酚与足量的Na2CO3溶液反应放出4molCO2
③1mol茶多酚与足量的NaOH溶液反应最多消耗10molNaOH
④能发生氧化、取代、加成、缩聚反应
⑤已知茶多酚易溶于水,是因为能与水分子之间形成氢键
⑥能使酸性KMnO4溶液褪色
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
A.KClO3在反应中失去电子B.此反应中每生成1 mol ClO2转移的电子数为1 mol
C.ClO2是氧化产物D.H2C2O4在反应中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )
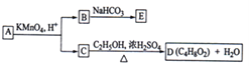
A.B的结构简式为HOOCCH2COOHB.C与乙醇发生了酯化反应
C.A可以与氢氧化钠溶液发生中和反应D.E的分子式为C3H2O4Na2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
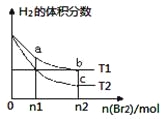
A. 若b、c点的平衡常数分别为K1、K2,则K1>K2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com