
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
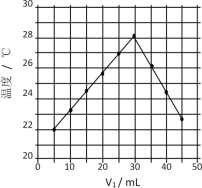
A.做该实验时环境温度低于22℃
B.该实验表明化学能可能转化为热能
C.该实验表明有水生成的反应一定是放热反应
D.NaOH溶液的浓度约为1.5mol/L
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
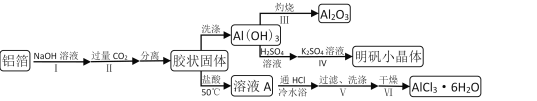
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤II中发生的化学方程式___;步骤Ⅲ发生的化学方程式___。
(2)步骤Ⅲ,下列操作合理的是___。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤Ⅳ的操作是___。
(4)步骤Ⅴ,过滤时,用到的玻璃仪器有___;洗涤时,合适的洗涤剂是___。
(5)步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___。
(6)由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室需用下列装置制备。
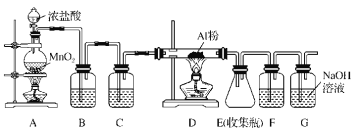
①装置A中发生反应的离子方程式为___。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是___。
③F中试剂的作用是___,用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列与溶液pH有关的计算
(1)室温下pH=2的HCl溶液和pH=10的NaOH溶液中由水电离出的c(H+)之比为____。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为__。
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液pH=3,则a:b=___。
(4)已知某温度时0.1molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___(用含a、b的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.物质A的转化率提高了B.平衡向逆反应方向移动了
C.物质B的质量分数减少了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图所示的转化关系中,![]() 、
、![]() 均为常见的金属单质;A、
均为常见的金属单质;A、![]() 在冷的
在冷的![]() 的浓溶液中均会发生钝化;
的浓溶液中均会发生钝化;![]() 为淡黄色的非金属单质。
为淡黄色的非金属单质。![]() 为红棕色固体氧化物,
为红棕色固体氧化物,![]() 为常见无色液体。
为常见无色液体。![]() 焰色为黄色,且能使酚酞变红(部分反应条件、反应过程中生成的水及其他产物略去)。
焰色为黄色,且能使酚酞变红(部分反应条件、反应过程中生成的水及其他产物略去)。

(1)![]() 的化学式为______。
的化学式为______。
(2)![]() 与
与![]() 反应的化学方程式为_____。
反应的化学方程式为_____。
(3)![]() 与氯气反应的离子方程式为_____。
与氯气反应的离子方程式为_____。
(4)![]() 与氨水反应的化学方程式为_______。
与氨水反应的化学方程式为_______。
(5)![]() 与
与![]() 反应的离子方程式为________。
反应的离子方程式为________。
(6)检验“黄色溶液”中阳离子的方案:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾晶体化学式为:KxFey(CN)znH2O,俗称黄血盐,常用作食品抗结剂。一种用NaCN(N显-3价)废液制取黄血盐的主要工艺流程:
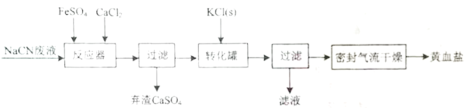
(1)实验室用绿矾固体配制FeSO4溶液时,应先________,再用蒸馏水稀释。
(2)“转化罐”中生成黄血盐晶体的反应类型为________。
(3)采用密封气流干燥取代在通风橱内干燥的原因是________。
(4)黄血盐的化学式可通过下列实验测定:
①准确称取4.220g样品加入水中充分溶解,将所得溶液转移至容量瓶配制成100.00mL溶液A。
②量取25.00mL溶液A,用2.000molL-1KMnO4溶液滴定,达到滴定终点时,共消耗KMnO4溶液15.25mL。反应如下(未配平):![]() ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
通过计算确定样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱去冶金工业排放烟气中![]() 的方法有多种。
的方法有多种。
(1)利用本生(Bunsen)热化学循环吸收![]() 工艺由下列三个反应组成:
工艺由下列三个反应组成:
![]()
![]()
![]()
![]()
![]()
![]()
则![]()
![]() ________
________![]() 。
。
(2)氧化锌吸收法:配制![]() 悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率
悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率![]() 随时间t的变化如图甲;溶液中部分微粒与pH的关系如图乙所示。
随时间t的变化如图甲;溶液中部分微粒与pH的关系如图乙所示。
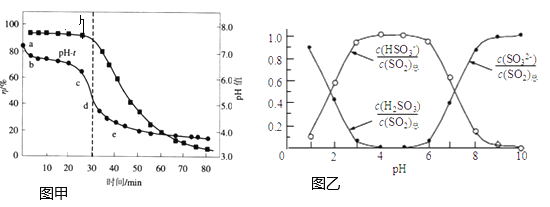
①为提高![]() 的吸收效率
的吸收效率![]() ,可采取的措施有:增大悬浊液中
,可采取的措施有:增大悬浊液中![]() 的量、________。
的量、________。
②图甲中的![]() 曲线ab段发生的主要化学方程式为________。
曲线ab段发生的主要化学方程式为________。
③![]() 时,溶液
时,溶液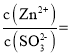 ________。
________。
(3)如图丙所示,利用惰性电极电解含![]() 的烟气回收S及
的烟气回收S及![]() ,以实现废物再利用。
,以实现废物再利用。
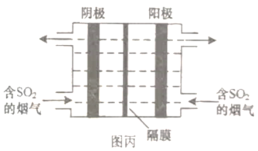
①阴极的电极反应式为________。
②每处理含![]() 的烟气,理论上回收S、
的烟气,理论上回收S、![]() 的物质的量分别为________、________。
的物质的量分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
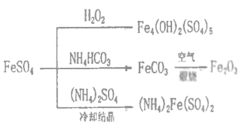
A.FeCO3转化为铁红的化学方程式:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
B.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小
C.制备Fe4(OH)2(SO4)5、Fe2O3、(NH4)2Fe(SO4)2的过程都发生了氧化还原反应
D.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.橙红色化合物A由五种元素组成,其中一种元素为原子半径最大的短周期元素(稀有气体元素除外),按如图流程进行实验。气体B为纯净物,能使湿润的红色石蕊试纸变蓝,溶液C呈黄色,沉淀D为砖红色沉淀。
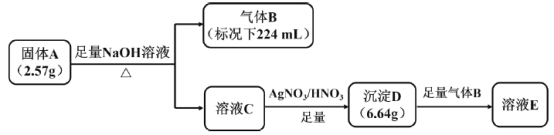
请回答:
(1)组成A的金属元素是___________(填元素符号),A的化学式是___________。
(2)沉淀D与足量B反应的离子反应方程式____________。
(3)A中的某种金属元素对应的单质可以通过铝热反应制备,写出化学反应方程式________。
II.某兴趣小组为了探究84消毒液(主要成分NaClO)和酒精混合使用是否存在安全隐患,利用如图装置进行实验。
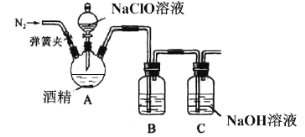
请回答:
(1)三颈烧瓶中出现黄绿色气体,请写出相应的化学方程式__________。(乙醇被氧化为乙醛)
(2)有同学用手触碰三颈烧瓶后发现,反应一段时间后装置温度升高,所以提出产生的气体中可能混有O2,请用离子方程式解释__________,该同学为了验证O2,打开弹簧夹,用带火星的木条检验,该操作的错误为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com