
【题目】完成下列与溶液pH有关的计算
(1)室温下pH=2的HCl溶液和pH=10的NaOH溶液中由水电离出的c(H+)之比为____。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为__。
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液pH=3,则a:b=___。
(4)已知某温度时0.1molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___(用含a、b的表达式表示)
【答案】1:100 2×10-11 mol·L-1 9:101 a+b=14
【解析】
(1)根据溶液中氢离子与氢氧根离子的实际来源来判断由水电离的c(H+);
(2)先计算混合溶液中c(OH-),再根据Kw=c(OH-)c(H+)计算c(H+);
(3)若所得混合液的pH=3,酸过量,根据c(H+)=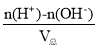 计算;
计算;
(4)某温度时测得0.1molL-1的NaOH溶液的pH为11,则Kw=0.1×10-11=1.0×10-12,混合液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,据此计算。
(1)室温下pH=2的HCl溶液中由水电离出的c(H+)=由水电离出的c(OH-)=溶液中的c(OH-)=![]() =
=![]() =10-12;pH=10的NaOH溶液中由水电离出的c(H+)=溶液中的c(H+)=10-10,则两者之比=10-12:10-10=1:100,故答案为1:100;
=10-12;pH=10的NaOH溶液中由水电离出的c(H+)=溶液中的c(H+)=10-10,则两者之比=10-12:10-10=1:100,故答案为1:100;
(2)在25℃时pH=9的溶液中c(OH)=![]() =105 mol/L,pH=11的溶液中c(OH)=
=105 mol/L,pH=11的溶液中c(OH)=![]() =103 mol/L,则等体积混合溶液中c(OH)=
=103 mol/L,则等体积混合溶液中c(OH)=![]() mol/L,混合溶液中c(H+)=
mol/L,混合溶液中c(H+)=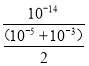 mol/L≈2×1011 mol/L,
mol/L≈2×1011 mol/L,
故答案为:2×1011;
(3)若所得混合液的pH=3,则酸过量,c(H+)=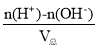 =
=![]() =0.001mol/L,解得a:b=9:101,
=0.001mol/L,解得a:b=9:101,
故答案为:9:101;
(4)因NaOH为强碱,则该溶液中的c(OH-)=0.1molL1,又某温度时测得0.1molL1的NaOH溶液的pH为11,则Kw=0.1×1011=1.0×1012,pH1=a的强酸溶液中氢离子浓度为10a mol/L,pH2=b的强碱溶液中氢氧根离子浓度为10b12 mol/L,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以100×10a=1×10b12,整理可得a+b=14,
故答案为:a+b=14。


科目:高中化学 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
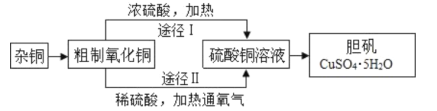
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使用____,灼烧后的坩埚应放在___上,不能直接放在桌面上;实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹;
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾,灼烧后含有少量铜的可能原因是____;
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径 II 实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、____、冷却结晶、___、自然干燥;
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是: ____、____;
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行___次;
(6)若测定结果x值偏高, 可能的原因是___。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,不溶于冷水,遇沸水或酸则迅速分解。某化学兴趣小组设计如图实验装置制取铋酸钠。装置丙中盛有Bi(OH)3(难溶于水)与NaOH溶液混合物。下列说法错误的是
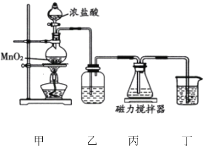
A.装置乙中盛装的试剂是饱和食盐水
B.装置丙中发生反应的离子方程式是:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O
C.从装置丙中获得产品的操作为:在冰水中冷却结晶、过滤、洗涤、干燥
D.为除去所得固体中混有的Bi(OH)3,可用稀盐酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A的最高正价与其最低负价的绝对值之差为6;A、D次外层都是8个电子,A与D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子;B有两个电子层,其最高正价与最低负价的代数和为0;C2-与氩原子具有相同的电子层结构。
(1)试写出上述各元素的符号:A______,B______,C______,D______。
(2)画出下列粒子的结构示意图:A:________________,C2-:__________。
(3)元素A、C、D形成简单离子的半径由大到小的顺序是________________。
(4)写出A、D的最高价氧化物对应水化物反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是
A.某溶液![]() 产生白色沉淀,说明原溶液中有Cl-
产生白色沉淀,说明原溶液中有Cl-
B.某溶液![]() 产生白色沉淀,说明原溶液中有SO42-
产生白色沉淀,说明原溶液中有SO42-
C.某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
D.某溶液![]() 产生蓝色沉淀,说明原溶液中有Cu2+
产生蓝色沉淀,说明原溶液中有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
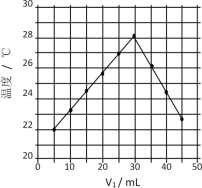
A.做该实验时环境温度低于22℃
B.该实验表明化学能可能转化为热能
C.该实验表明有水生成的反应一定是放热反应
D.NaOH溶液的浓度约为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com