
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
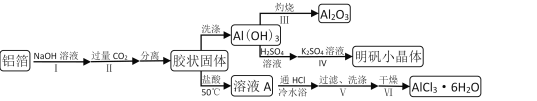
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤II中发生的化学方程式___;步骤Ⅲ发生的化学方程式___。
(2)步骤Ⅲ,下列操作合理的是___。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤Ⅳ的操作是___。
(4)步骤Ⅴ,过滤时,用到的玻璃仪器有___;洗涤时,合适的洗涤剂是___。
(5)步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___。
(6)由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室需用下列装置制备。
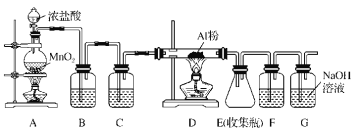
①装置A中发生反应的离子方程式为___。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是___。
③F中试剂的作用是___,用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为___。
【答案】NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 2Al(OH)3![]() Al2O3+3H2O BCD 加热浓缩、冷却结晶、过滤、洗涤、干燥 烧杯,玻璃棒,漏斗 浓盐酸 减压干燥或低温干燥 MnO2+4H++2Cl-
Al2O3+3H2O BCD 加热浓缩、冷却结晶、过滤、洗涤、干燥 烧杯,玻璃棒,漏斗 浓盐酸 减压干燥或低温干燥 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去HCl 防止水蒸气进入E中 碱石灰
Mn2++Cl2↑+2H2O 除去HCl 防止水蒸气进入E中 碱石灰
【解析】
①步骤I中铝箔和NaOH溶液反应生成NaAlO2;步骤II中CO2和NaAlO2溶液反应的到Al(OH)3胶状固体;步骤III中灼烧Al(OH)3可得Al2O3;步骤IV中,由于明矾在水中的溶解度随温度变化而变化,且变化量较大,可采用降温结晶得到明矾;制备AlCl3·6H2O晶体,需要将Al(OH)3用稀盐酸溶解,形成AlCl3的盐酸溶液,再冷却结晶、过滤、洗涤干燥得到AlCl3·6H2O晶体;②实验室制备无水AlCl3,观察实验装置,A为Cl2的发生装置,B中装有饱和食盐水,C中装有浓硫酸,D为Cl2和Al反应的装置,E为AlCl3的收集装置(题中已说明AlCl3易升华),F中装有浓硫酸(防止G中水蒸气进入到E中),G为Cl2的处理装置。
(1)步骤I中铝箔和NaOH溶液反应生成NaAlO2;步骤II中CO2和NaAlO2溶液反应的到Al(OH)3胶状固体,故步骤II中的化学反应为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3;步骤III中灼烧Al(OH)3得到Al2O3;则步骤III中的化学反应为:2Al(OH)3![]() Al2O3 + 3H2O;
Al2O3 + 3H2O;
(2)步骤III是灼烧Al(OH)3的操作,则:
A、坩埚需要擦干水分才能开始灼烧,A错误;
B、为得到纯Al2O3,需灼烧至恒重,B正确;
C、若要用坩埚钳移动用灼热的坩埚,需预热坩埚钳,以免坩埚因局部冷却而破裂,C正确;
D、坩埚取下后必须放在石棉网上冷却,D正确;
E、为确保称量准确,灼烧后必须冷却后称重,E错误;
故选BCD;
(3)步骤IV中,由于明矾在水中的溶解度随温度变化而变化,且变化量较大,可采用降温结晶得到明矾,具体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)过滤时,需要使用的玻璃仪器有烧杯、玻璃棒、漏斗;洗涤时,需要使用浓盐酸;
(5)步骤Ⅵ中为得到纯净的AlCl3·6H2O,可采用低压干燥或者低温烘干,这样可以比较结晶水的损失;
(6)①装置A为Cl2的发生装置,其中的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②装置B中盛放的饱和NaCl溶液,其作用是除去Cl2中的HCl气体;
③E为AlCl3的收集瓶,由于AlCl3对潮湿空气不稳定,故需要干燥的环境,F中的溶剂为浓硫酸,目的是防止G中的水蒸气进入到E中;G的作用是吸收Cl2,若要代替F和G,则代替装置中应该装有碱石灰,以吸收水蒸气和Cl2。


科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )

A.放电时,电流由石墨电极流向磷酸铁锂电极
B.放电时,负极反应式为LiC6-e-=Li++6C
C.电池总反应为M1-xFexPO4+LiC6![]() LiM1-xFexPO4+6C
LiM1-xFexPO4+6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
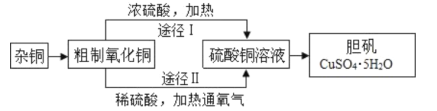
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使用____,灼烧后的坩埚应放在___上,不能直接放在桌面上;实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹;
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾,灼烧后含有少量铜的可能原因是____;
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径 II 实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、____、冷却结晶、___、自然干燥;
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是: ____、____;
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行___次;
(6)若测定结果x值偏高, 可能的原因是___。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molX和3molY在容器中发生2X(?)+3Y(气)![]() 3Z(?)反应已达平衡状态,若增加压强或降低温度,Y的体积分数都减小,则下列说法正确的是( )
3Z(?)反应已达平衡状态,若增加压强或降低温度,Y的体积分数都减小,则下列说法正确的是( )
A. 可能X、Z均是气体,也可能X、Z都不是气体。正反应放热
B. 可能X是气体,Z不是气体,正反应放热
C. 可能X是气体,Z是气体,正反应吸热
D. X、Z一定都是气体,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
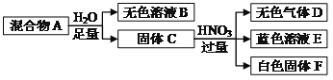
下列推断不正确的是( )
A.无色溶液B做焰色反应实验,火焰可能显紫色
B.白色固体F的主要成分是H2SiO3
C.混合物A中一定含有Na2SiO3、CuSO4和CaCO3
D.在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3<Na2CO3
B.在水中的溶解性:NaHCO3<Na2CO3
C.与盐酸反应的速率:NaHCO3<Na2CO3
D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,不溶于冷水,遇沸水或酸则迅速分解。某化学兴趣小组设计如图实验装置制取铋酸钠。装置丙中盛有Bi(OH)3(难溶于水)与NaOH溶液混合物。下列说法错误的是
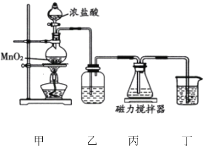
A.装置乙中盛装的试剂是饱和食盐水
B.装置丙中发生反应的离子方程式是:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O
C.从装置丙中获得产品的操作为:在冰水中冷却结晶、过滤、洗涤、干燥
D.为除去所得固体中混有的Bi(OH)3,可用稀盐酸洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
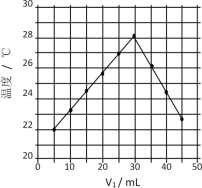
A.做该实验时环境温度低于22℃
B.该实验表明化学能可能转化为热能
C.该实验表明有水生成的反应一定是放热反应
D.NaOH溶液的浓度约为1.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com