
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )

A.放电时,电流由石墨电极流向磷酸铁锂电极
B.放电时,负极反应式为LiC6-e-=Li++6C
C.电池总反应为M1-xFexPO4+LiC6![]() LiM1-xFexPO4+6C
LiM1-xFexPO4+6C
D.充电时,Li+移向磷酸铁锂电极
科目:高中化学 来源: 题型:
【题目】Mn2+催化H2O2分解:2H2O2(aq)===2H2O(l)+O2(g) ΔH1,其反应机理如下:
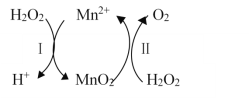
若反应Ⅱ的晗变为ΔH2,反应Ⅰ、Ⅱ的化学计量数均为最简整数比,则反应Ⅰ的晗变ΔH为( )
A. ΔH1+ΔH2 B. ΔH1-ΔH2 C. 2ΔH1-ΔH2 D. ΔH1-2ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为m kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025m kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)+ O2(g)![]() 2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g) ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)=_____mol
(2)若起始时加入1.2molSO2、0.6molO2和xmolSO3,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是________
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是______
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。

A.加了催化剂 | B.缩小容器体积 |
C.降低温度 | D.增加SO3的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 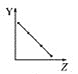 b.
b. 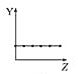 c.
c. 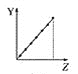 d.
d. 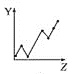
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用图示装置制取氯气,下列说法不正确的是( )

A. 该装置图中至少存在两处明显错误
B. 为了防止氯气污染空气,必须进行尾气处理
C. 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
D. 该实验中收集氯气的方法不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g) ![]() e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
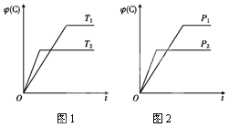
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中,用CO2和H2在催化剂的作用下合成甲醇,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),将1molCO2和3molH2在装有催化剂的反应器中反应8小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。下列说法正确的是( )
CH3OH(g)+H2O(g),将1molCO2和3molH2在装有催化剂的反应器中反应8小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。下列说法正确的是( )
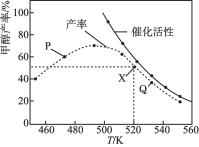
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的△H>0
CH3OH(g)+H2O(g)的△H>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2转化率
D.![]() 下,X点所对应甲醇的产率为50%,则平衡常数K=0.15
下,X点所对应甲醇的产率为50%,则平衡常数K=0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
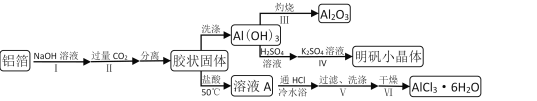
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤II中发生的化学方程式___;步骤Ⅲ发生的化学方程式___。
(2)步骤Ⅲ,下列操作合理的是___。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤Ⅳ的操作是___。
(4)步骤Ⅴ,过滤时,用到的玻璃仪器有___;洗涤时,合适的洗涤剂是___。
(5)步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___。
(6)由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室需用下列装置制备。
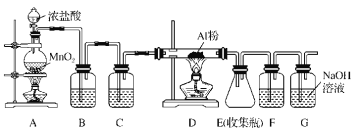
①装置A中发生反应的离子方程式为___。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是___。
③F中试剂的作用是___,用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com