
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
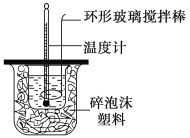
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
【答案】C DΔH1=ΔH2<ΔH3 -51.8 kJ·mol-1不能H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响反应的反应热
【解析】
(1)将NaOH溶液倒入小烧杯中,分几次倒入,会导致热量散失,影响测定结果;
(2)盐酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使盐酸与NaOH溶液混合均匀;
(3)H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJmol-1;中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,弱电解质存在电离平衡,电离过程是吸热过程;
(4)根据中和热计算公式Q=cm△T中涉及的未知数据进行判断;
(5)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果。
(1)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故选C;
(2)使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失,故选D;
(3)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1molL-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1molL-1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H1=△H2<△H3,故答案为:△H1=△H2<△H3;
(4)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:23.6℃,反应前后温度差为:3.05℃;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×![]() =1.2959kJ,即生成0.025mol的水放出热量为:1.2959kJ,所以生成1mol的水放出热量为1.2959kJ×
=1.2959kJ,即生成0.025mol的水放出热量为:1.2959kJ,所以生成1mol的水放出热量为1.2959kJ×![]() =51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
(5)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故答案为:不能;因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,1570C时开始分解:
(1)探究草酸的酸性
250C H2C2O4 K1 = 5.4 x 10-2,K2 = 5. 4 x 10 -5 ;H2CO3 K1=4.5x10-7 K2= 4.7X10-11
下列化学方程式可能正确的是________
A. H2C2O4 +CO32-=HCO3- +HC2O4- B. HC2O4- +CO32-= HCO3-+C2O42-
C. 2C2O42-+CO2+H2O=2HC2O4-+CO32- D. H2C2O4 +CO32-=C2O42-+H2O+CO2
(2)探究草酸分解产物
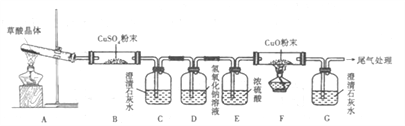
①实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用:_______,证明有CO气体生成的现象是:_____________________
②写出H2C2O4分解的化学方程式_____________________
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加人4mLO.O1mol/T. KMnO4酸性溶液和2mL O.1mol/L H2C2O4溶液, 再向乙试管中加人一粒黄豆大的MnSO4固体,摇匀。填写下表:
反应现象 | ______________ |
实验结论 | ______________ |
试管中发送反应的离子方程式 | ______________ |
(4)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度
实验步骤:准确称取2.OgNa2C2O4固体,配成1OO mL溶液,取出20.OOmL于锥形瓶中=再向瓶 中加人足量稀H2SO4 ,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.OOmL0
①高锰酸钾溶液应装在_______滴定管中。(填“酸 式”或“碱 式”)
②滴定至终点时的实验现象是:______________。
③Na2C2O4的纯度是:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.从碘水中萃取碘时,萃取剂应不溶于水,且比水更容易使碘溶解
D.分液时,分液漏斗内的下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快) 4VO2+O2
2VO2+SO3(快) 4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Na+ 数目最多的是( )
A.1mol/L Na2SO4溶液200mLB.0.9mol/L Na3PO4溶液200mL
C.2.5mol/L NaOH 溶液100mLD.1mol/L NaHCO3溶液300mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 元素周期表是按照元素相对原子质量大小排列而成的
B. 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C. 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D. 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,并用电解产生的 H2 还原 CuO 粉末来测定 Cu 的相对原子质量,同时验证氯气的氧化性。

完成下列填空:
(1) 写出甲装置中反应的化学方程式______________________________。
(2) 为完成上述实验,正确的连接顺序为 A 连______,B连_____(填写接口字母)。
(3)乙装置中 a 试剂可以是_______________。
(4) 测定 Cu 的相对原子质量。将w g CuO 置于硬质玻璃管中,按以下两个方案测得的数据计算 Cu 的相对原子质量
方案 1 | 方案 2 | |
U 型管+固体 | 硬质玻璃管+固体 | |
反应前的总质量/g | a | c |
反应后的总质量/g | b | d |
你认为较佳方案是_____________,另一个方案得到的 Cu 的相对原子质量会_______(选填“偏低”、或“偏高”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为_______。元素⑩在周期表中的位置为________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________,碱性最强的化合物的电子式是_______,⑤的单质在该化合物的水溶液中反应的离子方程式为_____。
(3)用电子式表示元素④与⑥的化合物的形成过程___________________,该化合物属于_____(填“共价”或“离子”)化合物。
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____(用化学式表示)。
(5)元素①的最简单氢化物的结构式为________,与该化合物相差一个CH2的同系物可用于形成燃料电池,写出电解质溶液呈碱性时负极的电极反应式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com