
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
根据上述流程图,回答下列问题:
(1)操作I的名称是 。
(2)步骤中②反应的化学方程式为 。
(3)步骤④中加热时通入HCl气流的作用是 。
(4)步骤⑤的离子反应方程式为 。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。
(1)过滤(1分)
(2)CaO+H2O=Ca(OH)2(1分) MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) (1分)
(3)增大HCl浓度抑制MgCl2的水解(1分)
(4)Mg2++2Cl- Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
(5)滤液(或浓缩液) Br2(2分,各1分)
解析试题分析:
海水中主要有Na+,Cl-,Mg2+,Br-,SO42-等离子,蒸发浓缩后取浓缩液加CaO后会产生Mg(OH)2↓,进行过滤,滤液中当然含有Na+,Cl-,Br-,SO42-等离子。取所得的Mg(OH)2加HCl后进行浓缩结晶得到MgCl2晶体。再在HCl氛围中加热使其失去结晶水,得到MgCl2后,在进行电解得到Mg和Cl2。
(1)将固体和液体分开采用过滤(2)步骤中②反应的化学方程式为CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(3)步骤④中加热时通入HCl增大HCl浓度,在HCl氛围中,抑制MgCl2的水解,不能直接加热,否则MgCl2晶体会发生水解得到Mg(OH)2(4)步骤⑤的离子反应方程式为Mg2++2Cl- Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2
Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2
考点:物质的分离与提纯(水解,离子方程式书写,实验操作等)


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:实验题
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸
点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。
某学生拟用左下图所示装置模拟工业制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有 、 ;
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中
ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1mL试样加入到锥
形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;此时发生的离子方程式
为: ;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
则原ClO2溶液的浓度为 g/L(用含字母的代数式表示)。
(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下:
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiCl4中精制TiCl4的方法是________(填字母)。
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:_________________;阴极产物是__________。
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
(4)如图是一个制取氯气并以氯气为原料进行反应的装置,
①装置A中发生反应的化学方程式为_____________________________________。
②在实验室中,某同学欲用如图所示装置净化氯气,则M、N中应盛放的试剂分别是__________、__________。(填试剂名称)
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯。Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体。试写出装置C中发生反应的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2?12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________, ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后, 将溶液分成两份,分别装入A、B试管中。 | |
| 步骤2:_____________________________ __________________________________ | ________________________证明有Na+,发 酵粉中有NaHCO3。 |
| 步骤3:_____________________________ ___________________________________ | ___________________________________ _______,结合步骤2中的结论,假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
FeSO4·7H2O广泛用于医药和工业领域。
(1)下面是以工业废铁屑为原料生产FeSO4·7H2O的流程图。
请填写下列空白。
①加适量碳酸钠溶液的目的是______________,反应I需要加热数分钟,其原因是___________。
②判断反应Ⅱ完成的现象是__________。反应Ⅱ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制。所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及____________.
③测定FeSO4·7H2O产品中Fe2+含量的方法是用KMnO4溶液滴定法(5Fe2++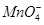 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取2.8500g FeSO4·7H2O产品,配制成250mL溶液;
Ⅱ.量取25.00mL待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000moL/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
某同学设计如图所示的滴定方式中,最合理的是____________(夹持部分略去)(填字母序号);判断此滴定实验达到终点的方法是____________;计算上述样品中FeSO4·7H2O的质量分数为________(用小数表示,保留三位小数);若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________;______________。
(2)已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
请填写下列空白。
①仪器的连接顺序为a接________、__________接_________、________接__________、__________接_____________。
②装置C中的X为______________;该装置中冷水的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验是化学的基础。下图为一化学实验装置图,图中,夹持仪器已略去,用“△”表示用酒精灯加热。
请仔细观察该实验装置图,回答问题:
(1)甲装置通入空气的导气管插入乙醇中的主要目的是
(2)乙装置用揉乱的铜丝,好处是
(3)乙装置的化学反应反应方程式为 ,反应中,转移电子的数目是 若有23g乙醇发生反应,至少需要通入标准状况下的空气 L
(4)写出一种检验反应产物的方法及现象
(5)该反应还可以用更简便的方法实现:取一束铜丝在酒精灯上加热,铜丝变黑,趁热插入盛有少量乙醇的试管中,铜丝又变红;如此反复多次即可。请写出实验中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是产生和收集气体的实验装置,该装置适合于
| A.用H2O2溶液和MnO2反应制取O2 |
| B.用浓盐酸和MnO2反应制取C12 |
| C.用稀硫酸与石灰石反应制取CO2 |
| D.用NH4C1和Ca(OH)2反应制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用下列各组中的物质制备并收集相应的气体,能采用如图所示装置的是
| A.浓氨水和固体NaOH制NH3 |
| B.过氧化氢溶液和二氧化锰制O2 |
| C.稀硝酸和铜片制NO |
| D.电石和饱和食盐水制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验装置的说法中正确的是 ( )。
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与稀硝酸反应产生气体的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com