
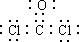 ��Ϊ�˷�ֹ�����¹ʣ�ʹ��ǰҪ�ȼ����ȷ��Ƿ���ʣ�д���������õ��Լ���������Һ��
��Ϊ�˷�ֹ�����¹ʣ�ʹ��ǰҪ�ȼ����ȷ��Ƿ���ʣ�д���������õ��Լ���������Һ������ ��1������������ԭ��Ӧ�е�ʧ������Ƚ��ԭ���غ�ȷ����һ�������д����Ӧ�ķ�Ӧ����ʽ��
��2�������ǹ��ۻ���������и�ԭ�Ӷ���8���ӵ��ȶ��ṹ�����γ����Թ��õ��Ӷԣ���̼�γ��ĶԹ��õ��Ӷԣ����γ�һ�Թ��õ��Ӷԣ����Թ����ĵ���ʽΪ��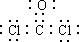 ���ȷ±�������HCl��������������Һ���飻
���ȷ±�������HCl��������������Һ���飻
��3������Xe��ԭ������Ϊ54����IԪ�أ��������ڵڢ���A�壩�������������������Ϊ80%�������20%��������ɵĻ�����壬�����ʵ���֮��Ϊ4��1���ɴ���ƽ��ʽ����
��4����1mol�����3.5mol������һ�ܱ������ڳ�ַ�Ӧ������������0.5mol�ķ���ͬʱ�а�ɫ�������ɣ����������غ㶨����������ѧʽ��
��� �⣺��1���÷�Ӧ�л��ϼ۱仯Ϊ��NH4NO3��N2O��NԪ����-3�ۡ�+1�ۣ�һ��Nԭ��ʧȥ4�����ӣ���+5�ۡ�+1�ۣ�һ��Nԭ�ӵ�4�����ӣ����Ե�ʧ����������С������Ϊ4����������淋ļ�����Ϊ1������ԭ���غ�ȷ����һ��������ΪH2O��Ȼ�����ԭ���غ���ƽ����Ԫ�أ����Ը÷�Ӧ�Ļ�ѧ����ʽΪ��NH4NO3$\frac{\underline{\;��\;}}{\;}$N2O��+2H2O����������1mol������������ת��4mol�ĵ��ӣ��ʴ�Ϊ��NH4NO3$\frac{\underline{\;��\;}}{\;}$N2O��+2H2O��4��
��2�������ǹ��ۻ���������и�ԭ�Ӷ���8���ӵ��ȶ��ṹ�����γ����Թ��õ��Ӷԣ���̼�γ��ĶԹ��õ��Ӷԣ����γ�һ�Թ��õ��Ӷԣ����Թ����ĵ���ʽΪ��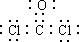 ���ȷ±�������HCl��������������Һ���飬�ʴ�Ϊ��
���ȷ±�������HCl��������������Һ���飬�ʴ�Ϊ��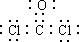 ����������Һ��
����������Һ��
��3��Xe��ԭ������Ϊ54��ԭ�ӽṹ����5�����Ӳ㣬����������Ϊ8������Ԫ�����ڱ��е����������壬�������Ϊ80%�������20%��������ɵĻ�����壬�����ʵ���֮��Ϊ4��1������ƽ��ʽ��Ϊ��$\frac{4��131+32}{5}$=111.2��
�ʴ�Ϊ�������������壻111.2��
��4��1mol�����3.5mol�������ܱ������У���һ��������ʹ��Ӧ��ϣ�ʣ����0.5mol��������Ӧ��3mol���������Ϊ��ԭ�ӷ��ӣ���n��Xe����n��F��=1��6��
��ѧʽΪXeF6��
�ʴ�Ϊ��XeF6��
���� ���⿼���˷���ʽ����д�������ӵļ��飬�Լ�Ԫ�������ڱ��е�λ�ü����������غ㶨����ȷ�����ʵĻ�ѧʽ��������Ϣϰ�⣬ע����Ϣ����ѧ֪ʶ�Ľ������ɣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ʼ������ת����ϵ�ǻ�ѧ�г�����ϵ����ͼ��ʾ����֪A��B��C������ͬһ��Ԫ��X����A��B��C֮������ת����
���ʼ������ת����ϵ�ǻ�ѧ�г�����ϵ����ͼ��ʾ����֪A��B��C������ͬһ��Ԫ��X����A��B��C֮������ת���� ��B��������С�մ�
��B��������С�մ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���������� | B�� | ������3��Ԫ�� | ||
| C�� | ����Ħ��������44g | D�� | 1 mol�������麬��2NA��̼ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 55.43% | B�� | 44.57% | C�� | 40% | D�� | 49% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��100�桢101 kPa�����£�1 molҺ̬ˮ����ʱ��Ҫ����40.69 kJ����������H2O��g���TH2O��l���ġ�H=+40.69 kJ•mol-1 | |
| B�� | ��֪CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-802.33 kJ•mol-1����CH4��ȼ����Ϊ802.33 kJ | |
| C�� | ϡ������0.1 mol•L-1NaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��H+��aq��+OH-��aq��=H2O��l����H=-57.3 kJ•mol-1 | |
| D�� | ��֪S��g��+O2��g���TSO2��s����H1��S��g��+O2��g���TSO2��g����H2�����H2����H1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪��25�桢1.013��105Pa�£�1mol������ȫȼ������Һ̬ˮ�ų�285kJ����������ش��������⣺
��֪��25�桢1.013��105Pa�£�1mol������ȫȼ������Һ̬ˮ�ų�285kJ����������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƾ���ȼ����ΪQ3 kJ | |
| B�� | ��ʹ46 g�ƾ�Һ����ȫȼ�գ����ָ������£��ͷų�������Ϊ��3Q1-Q2+Q3��kJ | |
| C�� | H2O��g����H2O��l���ͷų������������Ըù���Ϊ��ѧ�仯 | |
| D�� | �ӷ�Ӧ�ۿ�֪1mol C2H5OH��g����������2 mol CO2��g����3 mol H2O��g���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȳ��C2H2���ͼױ� | B�� | �Ҵ��ͱ�����CH3CH2CH2OH�� | ||
| C�� | �Ҵ������ѣ�C2H5OC2H5�� | D�� | ��ȩ�� HCHO�������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com