
| A. | O2- Na+Mg2+Al3+ | B. | O P S Cl | ||
| C. | A l3+Mg2+ Na+ F- | D. | K+ Mg2+ Al3+ H+ |
分析 微粒半径大小一般原则:电子层数不同,电子层数越多,半径越大;
电子层数相同的,质子数越多半径越小;
核外电子数相同的,质子数越多半径越小;据此解答.
解答 解:A.O2- Na+Mg2+Al3+具有相同的核外电子数,微粒半径随着核电荷数增多而减小,所以半径由小到大顺序:Al3+、Mg2+、Na+、O2-,故A错误;
B.O有两个电子层,Cl、S、P,都有三个电子层,质子数越多半径越小,所以0、Cl、S、P依次增大,故B错误;
C.Al3+、Mg2+、Na+、F-都有2个电子层,质子数越小,半径越大,所以半径由小到大顺序:Al3+、Mg2+、Na+、F-,故C正确;
D.钾离子具有3个电子层,Al3+、Mg2+都有2个电子层,且二者质子数逐渐减小,氢离子一个电子层,所以由小到大顺序:H+、Al3+、Mg2+、K+,故D错误;
故选:C.
点评 本题考查微粒半径比较,题目难度中等,为元素周期律中常考查知识点,学习中注意积累相关比较方法,注重元素周期律递变规律的应用.


科目:高中化学 来源: 题型:选择题
| A. | M g | B. | $\frac{1}{M}$g | C. | $\frac{6.02×1{0}^{23}}{M}$g | D. | $\frac{M}{{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取NaClO溶液,点在干燥的pH试纸上,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 将Cu与浓硫酸反应剩余的液体加入到盛有蒸馏水的烧杯中,以证明反应生成了CuSO4 | |
| D. | 用乙醇、乙酸制取乙酸乙酯的过程中发现忘加碎瓷片,可立即补加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.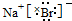 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属两原子间不可能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物 | |
| C. | 含有非极性键的分子,不一定是共价化合物 | |
| D. | 离子化合物中一定不含共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com