
 .
.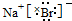 .
.分析 ①A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、B为Mg、C为Al;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,二者元素最低负化合价为-1,二者都处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;
③F在常温下是气体,性质稳定,是除氢气外最轻的气体,则F为He;
④G是除氢外原子半径最小的元素(不考虑稀有气体),则G为F元素.
解答 解:①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,即处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na,B为Mg,C为Al;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,D、E表现-1价,二者处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br,E为I;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体,则F为He;
④G是除氢外原子半径最小的元素,则G为F元素.
(1)由上述分析可知,A的名称是钠,B为Mg,位于周期表中第三周期ⅡA族,C为Al,原子结构示意图是 ,故答案为:钠;三;ⅡA;
,故答案为:钠;三;ⅡA; ;
;
(2)E为I,其单质颜色是紫黑色,故答案为:紫黑色;
(3)A元素与D元素形成化合物为NaBr,电子式是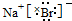 ,故答案为:
,故答案为: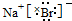 ;
;
(4)G的单质为氟气,与水反应的化学方程式是:2F2+2H2O═4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(5)F的元素符号是He,故答案为:He;
(6)在上述七种元素中,Na的金属性最强,最高价氧化物对应的水化物碱性最强的化学式是NaOH,F的非金属性最强,气态氢化物最稳定的化学式是HF,故答案为:NaOH;HF.
点评 本题综合性较强,考查的知识面较广,但比较基础,熟练掌握元素化合物性质与元素周期律,注意对基础知识的全面掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | O2- Na+Mg2+Al3+ | B. | O P S Cl | ||
| C. | A l3+Mg2+ Na+ F- | D. | K+ Mg2+ Al3+ H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: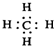 | |
| B. | 氮原子的L层电子的电子排布图: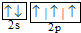 | |
| C. | 碳-12原子:${\;}_{6}^{12}$C | |
| D. | S2-的核外电子排布式:1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不仅有第2列元素的原子最外层有2个电子 | |
| B. | 第3~12列元素全为金属 | |
| C. | 第3列元素种类最多 | |
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x阴离子的半径小于y阳离子的半径 | |
| D. | x的电负性大于y的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在丙烯醛分子中,含有两种官能团 | |
| B. | 丙烯醛能发生加聚反应,生成高聚物 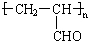 | |
| C. | 等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2 | |
| D. | 丙烯醛能使溴水褪色,能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时锌片作为正极 | |
| B. | 电池工作时从负极向外电路输出电子 | |
| C. | 电池工作时MnO2发生还原反应 | |
| D. | 电池工作时电能向化学能转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com