
����Ŀ��������Ԫ��A��B��C��Ԫ�����ڱ���������λ����ͼ��ʾ��A��B��C����Ԫ��ԭ�ӵ�������֮��Ϊ32��DԪ��ԭ�ӵ�����������Ϊ�������������2����������˵����ȷ����
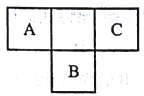
A. B����̬�⻯���C����̬�⻯���ȶ�
B. Ԫ��D�γɵ���̬�⻯��һ�������������η���
C. A��B����Ԫ�ص���̬�⻯����������ǵ�����������Ӧ��ˮ�������Ӧ���ҷ�Ӧ������ͬ
D. ����Ԫ�ص�ԭ�Ӱ뾶:B>D>A>C
���𰸡�D
������������ABC����Ԫ�������ڱ��е����λ�ÿ�֪�������A��ԭ��������x����B��x��9��C��x��2����x��x��9��x��2��32�����x��7����A��N��B��S��C��F��DԪ��ԭ�ӵ�����������Ϊ������������2�������D��̼Ԫ�ء�A���ǽ�����Խǿ���⻯����ȶ���Խǿ��F������õķǽ�����HF���ȶ�����ߣ�ѡ��A����ȷ��B��̼Ԫ�ص��⻯����ϩ��ƽ���ͽṹ��ѡ��B����ȷ��A�����������ᷴӦ�ǻ��Ϸ�Ӧ���Ҳ���������ԭ��Ӧ��H2S��Ũ���ᷴӦ��������ԭ��Ӧ����Ӧ���Ͳ�ͬ��ѡ��C����ȷ��D��ͬ����Ԫ�ش�����ԭ�����μ�С��ͬ����Ԫ��ԭ�Ӵ��϶���������������Ԫ�ص�ԭ�Ӱ뾶:B>D>A>C��ѡ��D��ȷ����ѡD��


 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�ټ��ء�Ѫ�쵰��Ҷ�����к��е�����Ԫ�������ǣ� ��
A. I��Mg��Fe B. Cu��Mg��I
C. I��Fe��Mg D. Fe��Mg��I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���������������Լ�����Σ������������Na2SO4������Cr2O72-��Fe3+;ij�����Ӹ�������ȡ�����ƵĹ�����ͼ1:
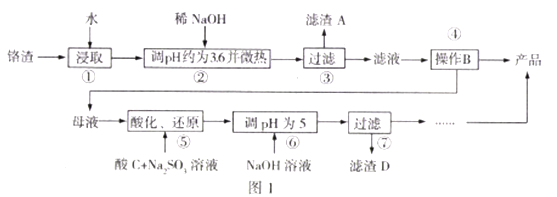
��֪:I.Fe3+��Cr3+��ȫ����(c�Q1.0��10-5mol/L)ʱpH�ֱ�Ϊ3.6��5;
��.Cr2O72-��ԭ����ΪCr3+��
(1)����2����pH=3.6��Ŀ��Ϊ______,���ȡ�������Ϊ_______��
(2)Na2SO4��Na2Cr2O7���ܽ�����¶ȱ仯������ͼ2,����B�ķ���Ϊ_________.
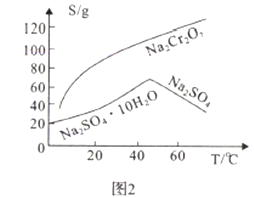
A.�����ᾧ�����ȹ��� B.����Ũ�������½ᾧ������
(3)����5����C����ѡ�����������Ϊ____________���ữ����ԭ���̷�����Ӧ�����ӷ���ʽΪ_______�������÷�Ӧ���Ϊԭ���(���Ե缫)�����ĵ缫��ӦʽΪ_______��
(4)Cr(OH)3���ܶȻ�����Ksp[Cr(OH)3]=_______
(5)Ϊ�˲ⶨ����3����Һ��Na2Cr2O7��Ũ�ȣ����в�������:
I.ȡ100mL��Һ;
��.��cmol/L�ı�KMnO4������Һ�ζ�bmLһ��Ũ�ȵ�FeSO4��Һ������KMnO4��ҺbmL;
��.ȡbmL��Һ��������FeSO4��Һ�ζ����ﵽ�ζ��յ�ʱ������dmLFeSO4��Һ������3����Һ��Na2Cr2O7�ĺ���Ϊ_________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ������ֲ���У�P���DZ���Ԫ��Ҳ�Ǵ���Ԫ��
B. ϸ���е������塢��������Һ�ݡ��߶������ϸ����������PԪ��
C. PԪ�ز��빹���������ڵĸ��ֻ��������֬��RNA��֬����
D. P��ά��Ҷ����Ĥ�Ľṹ�빦��������Ҫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ������� 
A.��ͼ 1 ��ʾ����ͭ�к��������������γ�ԭ��أ���ͭ������
B.��ͼ 2 ��ʾ������ 0.1 mol ����ת��ʱ���� 0.1 mol Cu2O ����
C.������ɫ��ѧ������Ƶ���ȡ Cu2O �ĵ�����ͼ 2 ��ʾ��ͭ�缫������ԭ��Ӧ
D.��ͼ 3 ��ʾ��װ���з��� Cu+2Fe3+�TCu2++2Fe2+�ķ�Ӧ���� X ���Ǹ�����Y ���IJ��Ͽ� ����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������йص������Һ��˵����ȷ����( )
A. ��Na2CO3��Һ��ˮϡ�ͺ�pH���Kw����
B. ����AgCl����ı�����Һ�м�����ˮ��c(Ag+)��Ksp(AgCl)������
C. pH=4.75Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��CH3COONa�Ļ����Һ�У�c(CH3COO��)+c(OH��)<c(H+)+c(CH3COOH)
D. �ֱ���pH=2��pH=3 �� CH3COOH��Һ�к͵����ʵ�����NaOH������CH3COOH��Һ������ֱ�ΪVa��Vb����10Va=Vb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ 200ml��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ� 19.2g����֪����ֻ����ԭΪ NO ���壩������һ�����������ۣ����������� �����������������ӵı仯��ͼ��ʾ��
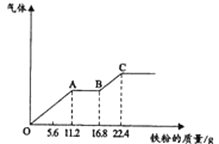
��1��AB �εķ�ӦΪ________________________________________
��2���������NO3�����ʵ���Ϊ__________________________��H2SO4��Ũ��Ϊ__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��½�1molCO ��3mol ˮ���������ܱյ������з������з�ӦCO��g��+H2O��g��CO2��g��+H2��g���ﵽƽ����CO2Ϊ0.75mol����ͨ��6mol ˮ�������ﵽ�µ�ƽ���CO2��H2�����ʵ���֮��Ϊ��������
A.1.2 mol
B.1.5 mol
C.1.8 mol
D.2.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ��
��1����25�桢101kPa�£�8g�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�176kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��2����ѧ��Ӧ�зų������ܣ��ʱ䣬��H���뷴Ӧ���������ļ��ܣ�E���йأ�
��֪��H2 ��g��+Cl2 ��g��=2HCl ��g����H=��185kJ/mol
E��H��H��=436kJ/mol E��Cl��Cl��=243kJ/mol
��E��H��Cl��= ��
��3��CuCl��s����O2��Ӧ����CuCl2��s����һ�ֺ�ɫ���壮��25�桢101kPa�£���֪�÷�Ӧÿ����1mol CuCl��s��������44.4kJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��4��FeCO3�ڿ����м��ȷ�Ӧ���Ƶ���ϵ��������ϣ�
��֪25�棬101kPaʱ��4Fe��s��+3O2��g��=2Fe2O3��s����H=��1648kJ/mol
C��s��+O2��g��=CO2��g����H=��393kJ/mol
2Fe��s��+2C��s��+3O2��g��=2FeCO3��s����H=��1480kJ/mol
FeCO3�ڿ����м��ȷ�Ӧ����Fe2O3���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com