
| A.水 | B.浓溴水 | C.酸性KMnO4溶液 | D.饱和NaHSO3溶液 |
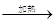 CuSO4+SO2↑+2H2O (2分)
CuSO4+SO2↑+2H2O (2分) FeSO4+H2↑ (2分) 饱和NaHS溶液 (1分)
FeSO4+H2↑ (2分) 饱和NaHS溶液 (1分) 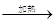 CuSO4+SO2↑+2H2O。
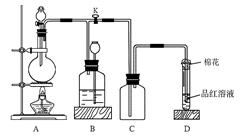
CuSO4+SO2↑+2H2O。 FeSO4+H2↑,收集H2S最好选择的是饱和NaHS溶液。H2S能和硫酸铜溶液反应生成黑色沉淀CuS,所以检验硫化氢放热试剂是硫酸铜溶液。2、H2S的制备、收集、性质检验以及尾气处理
FeSO4+H2↑,收集H2S最好选择的是饱和NaHS溶液。H2S能和硫酸铜溶液反应生成黑色沉淀CuS,所以检验硫化氢放热试剂是硫酸铜溶液。2、H2S的制备、收集、性质检验以及尾气处理

 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:不详 题型:填空题


 。
。 CoO2+LiC6,写出该电池放电时的正极反应式 。
CoO2+LiC6,写出该电池放电时的正极反应式 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
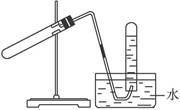
| A.加热NaHCO3制CO2 | B.用Cu与稀HNO3反应制NO |
| C.用NH4Cl与浓NaOH溶液反应制NH3 | D.用KMnO4与浓HCl反应制Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
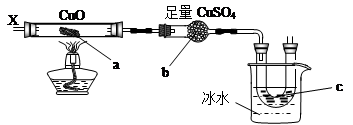
| A.H2 | B.NH3 | C.CH3CH2OH(气) | D.CO和H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
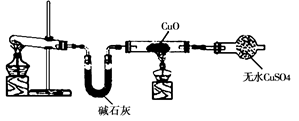
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com