
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
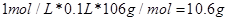
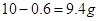
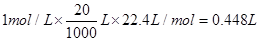 ,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体为CaCO3质量为
,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体为CaCO3质量为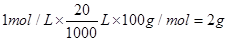


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:不详 题型:实验题
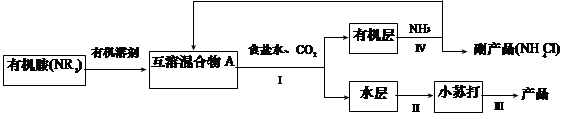
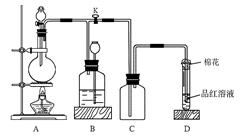
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
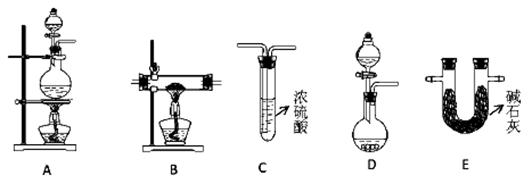
| A.水 | B.浓溴水 | C.酸性KMnO4溶液 | D.饱和NaHSO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O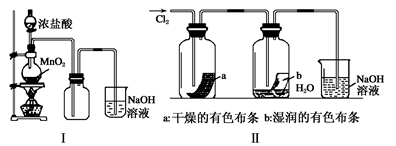
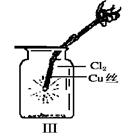
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2+2H+反应平衡常数 。
Cu(OH)2+2H+反应平衡常数 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com