
【题目】已知某些气态烃可以在氯气中燃烧,如:CH4+2Cl2![]() C+4HCl,现将一定量的某烃分成两等份,分别在氯气和氧气中燃烧,测得消耗的氯气和氧气在同温同压下的体积比为3:3.5,则该烃的分子式为( )
C+4HCl,现将一定量的某烃分成两等份,分别在氯气和氧气中燃烧,测得消耗的氯气和氧气在同温同压下的体积比为3:3.5,则该烃的分子式为( )
A. C2H4 B. C2H6 C. C3H6 D. C4H8
【答案】B
【解析】试题分析:设该烃的分子式为CxHy、物质的量为nmol,然后结合质量守恒定律计算出nmol该烃完全反应消耗氯气和氧气的物质的量,再结合“消耗的氯气和氧气在同温同压下的体积比为3:3.5”计算出x、y的关系,然后对各选项进行判断即可.
解:设该烃的分子式为CxHy、物质的量为nmol,
根据质量守恒定律可知,nol该烃与氯气反应消耗氯气的物质的量为:![]() =0.5nymol,
=0.5nymol,
nmol CxHy与氧气反应消耗氧气的物质的量为:nmol×(x+![]() )=n(x+
)=n(x+![]() )mol,
)mol,
消耗的氯气和氧气在同温同压下的体积比为3:3.5=0.5nymol:n(x+![]() )mol,整理可得:y=3x,
)mol,整理可得:y=3x,
所以该烃的最简式为CH3,满足条件的为B,
故选B.


科目:高中化学 来源: 题型:
【题目】下列有关物质的用途不正确的是
A. 高纯度的单质硅可用于制作计算机芯片 B. 钠钾合金可在快中子反应堆中作热交换剂
C. 二氧化硫不可用作熏蒸粉丝 D. 碳酸钠可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________。
(2)同浓度CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为__________。
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:_______。
(4)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①![]() ______;②
______;②![]() ______;
______;
③![]() _______;④
_______;④![]() _______。
_______。
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数:理由是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选修3——物质结构与性质]
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为: I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子的电子排布式为_____________,其第一电离能比Z元素原子的第一电离能________(填“高”或“低”)
(2)X的氯化物的熔点比Q的氯化物的熔点_______________(填“高”或“低”),理由是___________________
(3)光谱证实元素W的单质与强碱性溶液反应有W(OH)4]-生成,则W(OH)4]-中存在_______(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_________;晶体中每个镁原子周围距离最近的R原子有___________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由苯乙烯制得的聚苯乙烯可用于制造一次性餐具.![]()
(1)苯乙烯的分子式为 .
(2)苯乙烯制取聚苯乙烯的化学方程式为 .
Ⅱ.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”.为此人们开发出一种聚乳酸塑料来替代聚苯乙烯.聚乳酸合成过程如下:

(3)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是
A.互为同分异构体 B.水解最终产物相同
C.纤维素是纯净物 D.均是高分子化合物
(4)乳酸分子在所含官能团有 (填名称).
(5)根据结构推断聚乳酸可能发生的反应类型是 ,并据此说明用聚乳酸塑料替代聚苯乙烯塑料的好处是 .
(6)乳酸与足量Na反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热,观察到的现象是( )
A. 剧烈燃烧 B. 发出耀眼白光 C. 熔化的铝滴落 D. 失去金属光泽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:
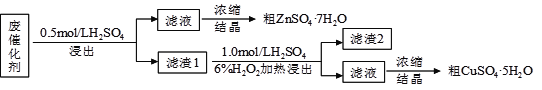
已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的___________(填标号)。

(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下: 。
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作 。
(4)写出第二次浸出的化学反应方程式 ,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加 。
(5)滤渣2的主要成分是 。浓缩、结晶得到硫酸锌晶体的主要仪器名称是 。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四个反应,其焓变和熵变如下表所示
反应 | A | B | C | D |
ΔH/kJ·mol-1 | 10.5 | 1.80 | -126 | -11.7 |
ΔS/J·mol-l·K -1 | 30.0 | -113.0 | 84.0 | -105.0 |
(1)在任何温度都能自发进行的反应是________;任何温度下都不能自发进行的反应是________。
(2)高温才可以自发进行的反应是________;低温有利于自发进行的反应是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com