
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
【答案】B
【解析】
A. Na3A的第一级水解平衡常数![]() ,A正确;
,A正确;
B. 在NaH2A溶液中,设起始量c(H2A-)=0.1mol/L,溶液中c(H+)=x
则有 H2A-![]() H++HA2-
H++HA2-
起始量 0.1mol.L 0 0
变化量 x x x
平衡量 0.1-x x x
![]() x≈7.9×10-5mol/L,溶液显酸性,
x≈7.9×10-5mol/L,溶液显酸性,![]() ,B错误;
,B错误;
C. 0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中,A3-的水解程度大于HA2-的水解程度,水电离程度前者大于后者,C正确;
D. 向H3A溶液中加入NaOH溶液至中性时,c(H+)=c(OH-),根据电荷守恒有c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-),D正确;
答案为B。


科目:高中化学 来源: 题型:
【题目】将铜片放入 115mL 某浓度的浓硫酸中,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到 2.24L(标准状况下)氢气。过滤残留固体,干燥后称量,质量减轻了 7.5g。求原硫酸的物质的量浓度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A为电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,容器C为盛有500mL各0.1mol/L的CuSO4和K2SO4混合液的电解槽,e、f均为铂电极。接通电路后,发现B上的c点显红色,C中阳极产生1.12L(标况)气体,电解过程不考虑能量损失。

(1)电源A上的b为______极,滤纸B上d为______极。
(2)写出B上所发生的反应的化学反应方程式_________。
(3)写出C容器中阳极产生的气体是_______(填名称),另一极增重____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写错误的是( )
A.![]() +HO-NO2
+HO-NO2![]()
![]() +H2O
+H2O
B.nCH2=CH2![]()
C.CH3COOH+CH3CH2OH![]() H2O+CH3COOCH2CH3
H2O+CH3COOCH2CH3
D.2CH3CH2OH+O2![]() 2CH3CHO
2CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是

A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)![]() CH3OH(l) △H=________ kJ/mol。
CH3OH(l) △H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有(______)
a.增大起始通入![]() 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,増大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) ![]() CH3OH(g)已经达到平衡状态的是(______)
CH3OH(g)已经达到平衡状态的是(______)
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衝转化率如图所示:
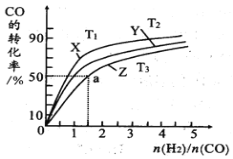
①温度T1°C、T2°C和T3°C由高到低的順序为:_________________;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________,该反应的压强平衡常数Kp的计算式为__________。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,字母a~j代表10种常见的短周期元素,请用相应的化学用语或者化学符号回答下列问题。

(1)d在周期表中的位置是___。与g同主族的下一周期的元素的原子序数为___。
(2)b的一种同位素含有8个中子,可用于考古时测定文物的年代,则该同位素的原子符号为___。
(3)在e、f、i、j四种元素中,简单离子半径最大的是___(填离子符号)。
(4)e、f、g三种元素的最高价氧化物对应的水化物中碱性最强的是___(填化学式)。
(5)c、i、j分别形成的简单气态氢化物中,最不稳定的是___(填化学式),还原性最强的是___(填化学式)。
(6)元素a与e可以形成离子化合物ea,请用电子式表示出其形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。已知 0.1mol 某烃 A完全燃烧后,生成 11.2L(标准状况)的![]() ,生成 10.8g 水,回答下列问题。
,生成 10.8g 水,回答下列问题。
(1)通过计算推导A的分子式_____________(写出计算过程)。
(2)写出A可能的结构简式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com