
【题目】下表是元素周期表的一部分,字母a~j代表10种常见的短周期元素,请用相应的化学用语或者化学符号回答下列问题。

(1)d在周期表中的位置是___。与g同主族的下一周期的元素的原子序数为___。
(2)b的一种同位素含有8个中子,可用于考古时测定文物的年代,则该同位素的原子符号为___。
(3)在e、f、i、j四种元素中,简单离子半径最大的是___(填离子符号)。
(4)e、f、g三种元素的最高价氧化物对应的水化物中碱性最强的是___(填化学式)。
(5)c、i、j分别形成的简单气态氢化物中,最不稳定的是___(填化学式),还原性最强的是___(填化学式)。
(6)元素a与e可以形成离子化合物ea,请用电子式表示出其形成过程___。
【答案】第二周期VIIA族 31 14C(或![]() C) S2- NaOH H2S H2S
C) S2- NaOH H2S H2S ![]()
【解析】
由元素在周期表的位置可知:a是H,b是C,c是O,d是F,e是Na,f是Mg,g是Al,h是P,i是S,j是Cl,由以上分析可知:
(1)d是F元素,在周期表位置是第二周期VIIA族,g是Al元素,它的原子序数为13,同主族的下一周期的元素的原子序数为13+18=31;
答案为第二周期VIIA族,31。
(2)b为C元素,它的质子数为6,它的一种同位素含有8个中子,质量数为6+8=14,可用于考古时测定文物的年代,则该同位数的符号为14C(或![]() );
);
答案为14C(或![]() )。
)。
(3)在Na、Mg、S、Cl四种元素中,简单离子S2-和Cl-具有相同的电子层结构,离子半径随着核电荷的递增而减小,则离子半径S2->Cl-,同理Na+和Mg2+也具有相同的电子层结构,离子半径随着核电荷的递增而减小,则离子半径Na+>Mg2+,由于S2-、Cl-电子层有三层,Na+、Mg2+电子层是二层,所以离子半径S2->Cl->Na+>Mg2+,离子半径最大的是S2-;
答案为S2-。
(4)Na、Mg、Al三种元素处于同一周期,从左至右,金属性依次减弱,其最高价氧化物对应的水化物中碱性依次减弱,故碱性NaOH>Mg(OH)2>Al(OH)3,碱性最强的为NaOH;
答案为NaOH。
(5)O、S、Cl三种元素,非金属性O>S(同主族性质递变),Cl>S(同周期性质递变),则S的非金属性在三种元素中最弱,因而氢化物最不稳定,其还原性最强;
答案为H2S,H2S。
(6)元素H与Na可以形成离子化合物NaH,用电子式表示出其形成过程为:![]() ;
;
答案为![]() 。
。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是____。
A.CH3CH2CH2CHO 与 ![]() B.
B.![]() 与
与 ![]()
C.![]() 与
与 ![]() D.
D.![]() 与
与 ![]()
E.![]() 与
与![]() F.戊烯与环戊烷
F.戊烯与环戊烷
(2) 用系统命名法命名下列物质:
①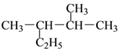 __________________; ②
__________________; ②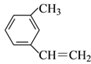 ________________;
________________;
③(CH3)2C=CHCH=CH2 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,正确的是
A. 区分晶体和非晶体最可靠的科学方法是对固体进行 X射线衍射
B. 离子键、金属键无方向性和饱和性,而所有共价键都有方向性和饱和性
C. 处于能量最低状态时,外围电子排布为4d15s2的某元素原子,M能层共有8个电子,该元素位于![]() 区第ⅢB族
区第ⅢB族
D. 对充有氖气的霓虹灯管通电,灯管发出红色光.产生这一现象的主要原因是电子由基态向激发态跃迁时以光的形式释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族
D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
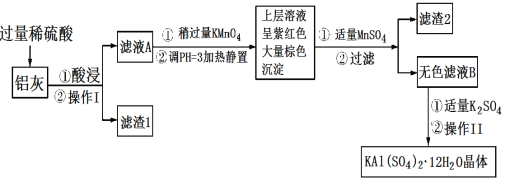
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验方案合理的是________。
A.配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解
B.在检验醛基配制Cu(OH)2悬浊液时,在一定量CuSO4溶液中,加入少量NaOH溶液
C.验证RX为碘代烷,把RX与烧碱水溶液混合加热,将溶液冷却后再加入硝酸银溶液
D.无水乙醇和浓硫酸共热到170 ℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
(2)写出D中制乙烯的化学方程式: _____________________________;
(3)欲除去混在苯中的少量苯酚,下列实验方法正确的是________(填序号)
A.分液 B.加入氢氧化钠溶液后,充分振荡,静置后分液
C.加入过量溴水,过滤 D.加入FeCl3溶液后,过滤
B中化学方程式: ____________________________;
C中化学方程式: ____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
阳离子 | K+、Ba2+、Ag+、Mg2+ |
阴离子 | Cl-、SO32-、CO32-、AlO2-、MnO4- |
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12。则混合物组成中肯定不存在的离子是________。
(2)向(1)所得溶液中滴加盐酸,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。则肯定存在的离子是________,可以排除的离子是________。
(3)取以上实验的上层澄清液,滴加AgNO3溶液,有白色沉淀生成。你认为还有哪些离子尚待检验:________(填离子符号),请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论):____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com