
【题目】一种长效、缓释阿司匹林的合成路线如下图所示:
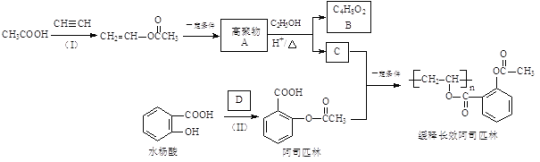
完成下列填空:
已知: RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)
RCOOR"+R′OH(R、R′、R"代表烃基)
(1)结构简式:A______________,B_______________;
(2)反应(Ⅰ)的反应类型为_________________,缓释长效阿司匹林结构中与“缓释作用”有关的官能团的名称为________________。
(3)D为乙酸酐,结构简式为![]() ,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
,写出一种与D互为同分异构体且能发生银镜反应的酯类的结构简式:__________。
(4)已知水杨酸酸性主要来源于“![]() ”,阿司匹林中将“
”,阿司匹林中将“![]() ”转化为“
”转化为“![]() ”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
”能大大降低对肠胃的刺激,由此你可以得出的结论是_________。
(5)已知:①乙炔与无机酸的反应和反应(Ⅰ)类似;②![]() ,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(
,现以乙炔、甲醇为原料,无机试剂任选,合成丙烯酸甲酯(![]() )_________。(合成路线常用的表示方式为:
)_________。(合成路线常用的表示方式为:![]() )
)
【答案】
![]() 加成 酯基
加成 酯基 ![]() 生成
生成![]() 可以降低阿司匹林的酸性
可以降低阿司匹林的酸性 ![]()
【解析】
由题中信息可知该反应过程为反应(I)为加成反应反应过程为![]() H+
H+![]()
![]() ,
,![]() 在一定条件下发生加聚反应,生成的加聚产物A结构为
在一定条件下发生加聚反应,生成的加聚产物A结构为 ,由题中信息RCOOR′+R"OH
,由题中信息RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)可知
RCOOR"+R′OH(R、R′、R"代表烃基)可知![]() 先反应生成
先反应生成![]() 和产物
和产物![]() (物质C),随后与阿司匹林酯化反应生成缓释长效阿司匹林。
(物质C),随后与阿司匹林酯化反应生成缓释长效阿司匹林。
(1)由分析可知A为![]() 的加聚反应的产物,故A的结构简式为
的加聚反应的产物,故A的结构简式为 ;
;
由已知RCOOR′+R"OH![]() RCOOR"+R′OH(R、R′、R"代表烃基)可知先发生取代反应生成
RCOOR"+R′OH(R、R′、R"代表烃基)可知先发生取代反应生成![]() ,
,![]() 与乙醇在酸性条件下加热发生酯化反应反应,故B为
与乙醇在酸性条件下加热发生酯化反应反应,故B为![]() ;
;
(2)由分析可知反应(Ⅰ)方程式为![]() H+
H+![]()
![]() ,所以该反应为加成反应,
,所以该反应为加成反应, 中官能团为酯键;
中官能团为酯键;
(![]() ;
;
(4)生成![]() 可以降低阿司匹林的酸性;
可以降低阿司匹林的酸性;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请用对应的化学符号回答下列问题:

(1)D在元素周期表中的位置是____。
(2)E元素所形成的气态氢化物的电离方程式____。
(3)B、C两元素的单质较活泼的是___。(填元素符号)
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:___、___。
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为__。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为__C表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为___,该物质___(填“能”或“不能”)溶于氨水,___(填“能”或“不能”)溶于氢氧化钠溶液,若能写出发生反应的离子方程式___。
(7)G元素的非金属性比H元素的非金属性___(选填“强”、“弱”),能说明这一事实的化学方程式是___(任写一个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两同学为制得纯净的Fe(OH)2,使用如图所示的装置,A管中是Fe和H2SO4,B管中是NaOH溶液:

(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是___________;
(2)同学乙:打开a,使A管中反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是___________,B中发生反应的离子方程式为____________________________________
(3)在制备纯净的Fe(OH)2实验中,一定要注意避免Fe(OH)2被氧化,一旦实验失败就会看到白色絮状沉淀逐渐变为灰绿色,最后变成红褐色,请写出这个过程的化学方程式,并用单线桥法标出电子转移的方向和数目:_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 25℃时,同体积、浓度均为0.10molL-1的CH3COOH溶液和HX溶液,分别与同体积0.10molL-1NaHCO3溶液混合,产生CO2的体积随时间变化如图,下列说法错误的是( )
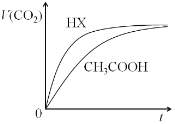
A.原溶液中c(H+):HX溶液>CH3COOH溶液
B.与CH3COOH反应结束后的溶液中c(Na+)>c(CH3COO-)
C.反应结束后两溶液中,c(CH3COO-)<c(X-)
D.由该实验可知HX为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式______________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备![]() ,写出阳极的电极反应式:_______。
,写出阳极的电极反应式:_______。
(3)某课题组以上述废玻璃粉末(含有SiO2,Fe2O3,CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净,沉淀洗涤的的操作是_______。
②反应①的离子方程式为____________。
③操作I的名称是_____________。
④已知:M[Ce(OH)4]=208g/mol,氧化还原滴定法测定制得的Ce(OH)4产品纯度的流程为:称取0.600gCe(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4标准液滴定,消耗25.00mL标准液。该产品中Ce(OH)4的质量分数为____________(小数点后保留两位),若滴定所用FeSO4溶液己在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度___________(“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
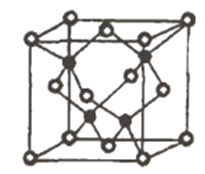
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钻可无限互溶,其固体为面心立方晶格。铂钻合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物CuF用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________________方法区分晶体、准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为________________。
(3) [H2F]+[SbF6]ˉ (氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______________,与[H2F]+具有相同空间构型且中心原子与F原子同周期的分子是_____________。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。![]() 中心原子的杂化类型是____________;氟化铵中存在_______________(填字母)。
中心原子的杂化类型是____________;氟化铵中存在_______________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SF4被广泛用作高压电气设备的绝缘介质。SF4是一种共价化合物,可通过类似于Bom-Haber循环能量构建能量图计算相关键能。则F-F键的键能为_____kJ/mol,S-F键的键能为______ kJ/mol。
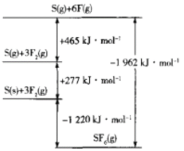
(6)CuCl的熔点为326℃,能升华,熔化呈液态时不导电;CuF的熔点为1008℃,熔化呈液态时能导电。
①CuF中Cu+的基态价电子排布式________铜元素位于元素周期________区,金属Cu的堆积模型为__________________。
②CuF的熔点比CuCl的高,原因是______________
③已知NA为阿伏加德罗常数的值,CuF的密度为7.1g/cm3,晶胞结构如图所示,则CuF的晶胞参数a=_______nm(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
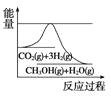
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。
实验 |
Ⅰ |
Ⅱ |
现象 | 连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色 | 连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象 |
下列说法正确的是
A.仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+
B.Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极
C.Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转
D.对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com