
【题目】下列离子方程式正确的是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
【答案】A
【解析】
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-,符合反应事实,A正确;
B.向碳酸氢钠溶液中加入氢氧化钠,反应产生正盐和水:HCO3-+ OH-=CO32-+H2O,B错误;
C.向FeCl3溶液中加入铜片,电荷不守恒,应该是:2Fe3++Cu=2Fe2++Cu2+,C错误;
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液,应该以不足量的NaHSO4为标准,离子方程式是H++SO42-+Ba2++OH-=BaSO4↓+H2O,D错误;
答案选A。
【点晴】
离子方程式的书写和正误判断
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应物。如2Fe+6H+===2Fe3++3H2↑,就不符合客观事实。
(2)看“===”“![]() ”“↑”“↓”等是否正确。
”“↑”“↓”等是否正确。
(3)看表示各物质的化学式是否正确。如HCO3-不能写成CO32-+H+,HSO4-通常应写成SO42-+H+,HCOO-不可写成COOH-等。
(4)看是否漏掉离子反应。如Ba(OH)2溶液与硫酸铜溶液反应,既要写Ba2+与SO42-的离子反应,又要写Cu2+与OH-的离子反应。
(5)看电荷及质量是否守恒。如FeCl2溶液与Cl2反应,不能写成Fe2++Cl2===Fe3++2Cl-,而应写成2Fe2++Cl2===2Fe3++2Cl-。
(6)看反应物或产物的配比是否正确。如稀H2SO4与Ba(OH)2溶液反应不能写成H++OH-+SO42-+Ba2+===BaSO4↓+H2O,应写成2H++2OH-+SO42-+Ba2+===BaSO4↓+2H2O。
(7)看是否符合题设条件及要求。如“过量”、“少量”、“等物质的量”、“适量”、“任意量”以及滴加顺序等对反应离子方程式的影响。如往FeBr2溶液中通入少量Cl2的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-;往FeI2溶液中通入少量Cl2的离子方程式为:2I-+Cl2===I2+2Cl-。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述不正确的是( )

A.气体A是NH3,B气体是CO2
B.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2=NaHCO3↓+NH4+
C.第Ⅲ步得到的晶体是Na2CO3·10H2O
D.第Ⅳ步操作的过程主要为加热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
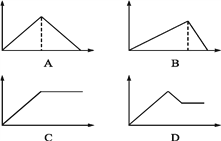
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.22.4 L H2O的物质的量为1mol
B.常温常压16 g O2的物质的量为0.5mol
C.标准状况下16 g O2中含有的氧原子数为0.5mol
D.物质的量浓度为0.5 mol·L-1 MgCl2 溶液中,Cl-浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸的物质的量浓度18.0 mol·L-1
B.1molZn与足量的该硫酸反应能产生22.4L H2
C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H(![]() )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]()
(1)生成A的反应类型是___________,F中所含官能团的结构简式为______________。
(2)B的结构简式是___________;“B→C”的反应中,除C外,另外一种产物名称是______。
(3)D+G→H的化学方程式是_____________________________________________。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有5组峰,且峰面积比为1:2:2:2:1的结构简式为_____________________。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成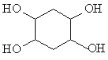 ,写出合成路线______________。(合成路线流程图示例:H2C=CH2
,写出合成路线______________。(合成路线流程图示例:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5)。
CH3COOC2H5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长余辉材料在发光照明、交通等领域具有广泛的应用前景。下图是一种利用大理石(主要成分CaCO3和MgCO3)和铝土矿(主要成分Al2O3,还含少量Fe2O3杂质)制备一种长余辉材料(Ca12Al14Ox)的工艺流程图。回答下列问题:
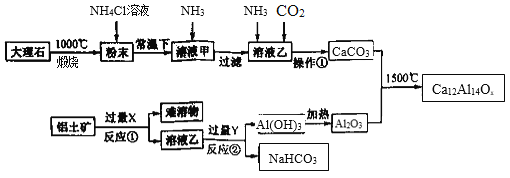
(1)Ca12Al14Ox中x的数值为 ______,试剂X的名称是_________。
(2)NH4Cl溶液能溶解“粉末”的原因是_________,发生的主要反应的化学方程为______。
(3)反应②的离子方程式为 _______。
(4)实验室加热Al(OH)3应在________(填仪器名称)进行;操作①包括_____、干燥等。
(5)若溶液甲中c(Mg2+) <5×10-5molL-1元素损失,此时应调节溶液pH大于______,为减少钙元素损失,应控制溶液甲中c(Ca2+)≤______。常温下Ksp[Mg(OH)2]=5×10-11,Ksp[Ca(OH)2]=5×10-6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H= ____kJmol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4molL-1SO3,此时SO2的转化率为_______,欲提高O3的利用率可采取的措施有_______(填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______molNa2SO4。
 ,
,
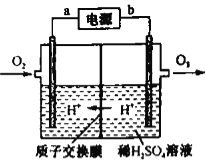
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____极,通入O2的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列说法正确的是( )
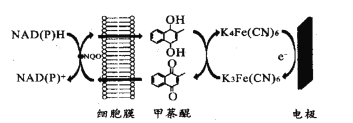
A.图中所示电极为阳极,其电极反应式为K4Fe(CN6)-e-=K3Fe(CN)6
B.甲荼醌在阴极发生氧化反应
C.工作时K+向图中所示电极移动
D.NAD(P)H转化为NAD(P)+的过程失去电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com