
【题目】如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述不正确的是( )

A.气体A是NH3,B气体是CO2
B.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2=NaHCO3↓+NH4+
C.第Ⅲ步得到的晶体是Na2CO3·10H2O
D.第Ⅳ步操作的过程主要为加热分解
【答案】C
【解析】
饱和食盐水中先通入过量的氨气,得到氨气和食盐的饱和溶液,再通入足量的二氧化碳,生成碳酸氢钠的悬浊液,过滤后加热固体,碳酸氢钠分解为碳酸钠。
A. 氨气极易溶于水,二氧化碳在水中的溶解度较小,依据侯德榜制碱的原理:向氨化的饱和食盐水中通入二氧化碳气体析出碳酸氢钠,所以A为氨气,B为二氧化碳,故A正确;
B. 第Ⅱ步反应方程式为NH3H2O+CO2+NaCl═NH4Cl+NaHCO3↓,离子方程式为Na++NH3+H2O+CO2=NaHCO3↓+NH4+,故B正确;
C. 第Ⅱ步反应方程式为NH3H2O+CO2+NaCl═NH4Cl+NaHCO3↓,过滤从沉淀池中分离沉淀NaHCO3晶体,所以第Ⅲ步得到的晶体是NaHCO3,故C错误;
D. 第Ⅳ步操作是将晶体碳酸氢钠直接加热分解得到碳酸钠固体,发生反应2NaHCO3![]() Na2CO3+H2O+CO2↑,所以第Ⅳ步操作的过程主要为加热分解,故D正确。
Na2CO3+H2O+CO2↑,所以第Ⅳ步操作的过程主要为加热分解,故D正确。
选C。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致 NH3 产率降低。我国科研人员研制了 Ti-H-Fe 双温区催化剂(Ti-H 区域和 Fe 区域的温度差可超过 100℃)。Ti-H-Fe 双温区催化合成氨的反应历程如图,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是

A.①为氮氮三键的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.③为N 原子由 Fe 区域向 Ti-H 区域的传递过程
D.使用 Ti-H-Fe 双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图,回答下列问题:

(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃ 时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是
A. 3Cl2+6KOH===5KCl+KClO3+3H2O
B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D. 2AgNO3+BaCl2===2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:①![]() ΔH1=-566.0 kJ·mol-1②
ΔH1=-566.0 kJ·mol-1②![]() ΔH2=-116.5 kJ·mol-1③
ΔH2=-116.5 kJ·mol-1③![]() ΔH3=+180.5 kJ·mol-1,废气中NO2 与CO 转化成无污染气体的热化学方程式为____。
ΔH3=+180.5 kJ·mol-1,废气中NO2 与CO 转化成无污染气体的热化学方程式为____。
(2)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1∶2、1∶1.5、3∶1时,NO脱除率随温度变化的曲线如图所示。

①曲线a中,NO的起始浓度为6×10-4mg·m-3,从X点到Y点经过10 s,则该时间段内NO的脱除速率为___________mg· m-3·s-1。
②曲线c对应的NH3与NO的物质的量之比是___,其理由是___。
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程的能量变化模拟计算结果如图所示。
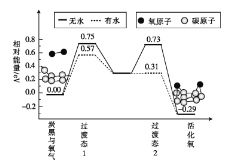
无水情况下,一个氧分子的活化能为__ ,容易活化氧分子的条件是___(填“有水”或“无水”)。
(4)利用反应![]() 构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。
构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。
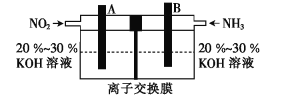
①B极的电极反应式为___。
②若反应转移1.2 mol电子,A极生成N2的体积为___L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2通入足量的氢氧化钠溶液,温度不同时充分反应后产物溶液中除大量OH-外,还有Cl-、ClO-、ClO3-,已知:Cl2+OH-→Cl-+ClO-+H2O(冷碱)、Cl2+OH-→Cl-+ClO3-+H2O(热碱),并知ClO-、ClO3-离子的物质的量比为2:1,试问原混合气体中Cl2与反应后溶液中的Cl-物质的量之比为( )
A.2:5B.3:1C.1:1D.5:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
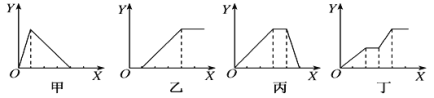
A.丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
B.丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
C.乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D.甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com