
【题目】Cl2通入足量的氢氧化钠溶液,温度不同时充分反应后产物溶液中除大量OH-外,还有Cl-、ClO-、ClO3-,已知:Cl2+OH-→Cl-+ClO-+H2O(冷碱)、Cl2+OH-→Cl-+ClO3-+H2O(热碱),并知ClO-、ClO3-离子的物质的量比为2:1,试问原混合气体中Cl2与反应后溶液中的Cl-物质的量之比为( )
A.2:5B.3:1C.1:1D.5:7
科目:高中化学 来源: 题型:
【题目】CO 和 NO 是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展, 汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H ______0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJmol -1
C(s) + O2 (g)=CO2 (g) △H= b kJmol -1
2C(s) + O2 (g)=2CO(g) △H= c kJmol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=______kJmol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 a molCO、b molNO 充入一恒压真空密闭容器。已知起始压强为 c kPa,到达平衡时, 测得N2 的物质的量为 d mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=_____(用含 a、b、c、d 的式子表示)
②该条件下,可判断此反应到达平衡的标志是_____。
A.单位时间内,断裂 2n molC=0 同时形成 n mol N≡N
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2 的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:
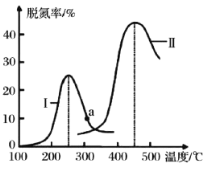
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为_____________。
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为________。
(5)己知常温下, Kb(NH3·H 2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11。此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)= ____mol/L,将脱氮反应后生成CO2 通入氨水中使溶液恰好呈中性,则此时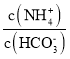 =____________(保留小数点后4位数字)
=____________(保留小数点后4位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述不正确的是( )

A.气体A是NH3,B气体是CO2
B.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2=NaHCO3↓+NH4+
C.第Ⅲ步得到的晶体是Na2CO3·10H2O
D.第Ⅳ步操作的过程主要为加热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块镁铝合金(不含其它物质)投入到50ml的稀盐酸溶液中,充分反应后,固体无剩余,向所得溶液中逐滴滴入cmol/LNaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
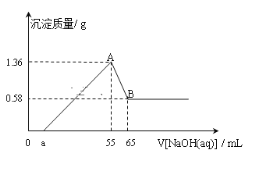
(1)图中B点表示沉淀的化学式为___;AB段发生反应的离子方程式为___。
(2)合金中金属铝的物质的量为___mol;
(3)稀盐酸溶液的浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
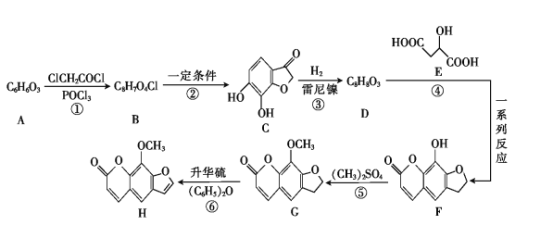
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
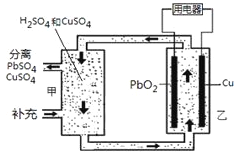
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
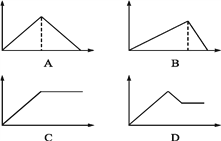
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长余辉材料在发光照明、交通等领域具有广泛的应用前景。下图是一种利用大理石(主要成分CaCO3和MgCO3)和铝土矿(主要成分Al2O3,还含少量Fe2O3杂质)制备一种长余辉材料(Ca12Al14Ox)的工艺流程图。回答下列问题:
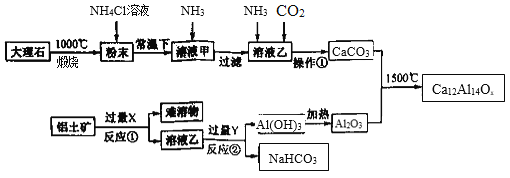
(1)Ca12Al14Ox中x的数值为 ______,试剂X的名称是_________。
(2)NH4Cl溶液能溶解“粉末”的原因是_________,发生的主要反应的化学方程为______。
(3)反应②的离子方程式为 _______。
(4)实验室加热Al(OH)3应在________(填仪器名称)进行;操作①包括_____、干燥等。
(5)若溶液甲中c(Mg2+) <5×10-5molL-1元素损失,此时应调节溶液pH大于______,为减少钙元素损失,应控制溶液甲中c(Ca2+)≤______。常温下Ksp[Mg(OH)2]=5×10-11,Ksp[Ca(OH)2]=5×10-6。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com