
【题目】将一块镁铝合金(不含其它物质)投入到50ml的稀盐酸溶液中,充分反应后,固体无剩余,向所得溶液中逐滴滴入cmol/LNaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
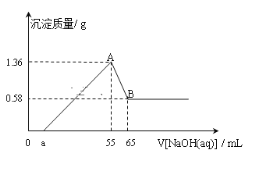
(1)图中B点表示沉淀的化学式为___;AB段发生反应的离子方程式为___。
(2)合金中金属铝的物质的量为___mol;
(3)稀盐酸溶液的浓度为___mol/L。
【答案】Mg(OH)2 Al(OH)3+OH-=AlO2-+2H2O 0.01 1.1
【解析】
根据图示,oa段没有沉淀生成,发生反应的离子方程式是H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-= Mg(OH)2↓、Al3++3OH-= Al(OH)3↓,最后AB段是Al(OH)3的溶解:Al(OH)3+OH-=AlO2-+2H2O。
(1)B点表示氢氧化铝沉淀完全溶解, B点表示沉淀的化学式为Mg(OH)2;AB段是Al(OH)3的溶解,发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(2)根据图像,Mg(OH)2的质量是0.58g,Al(OH)3的质量是1.36g-0.58g=0.78g,则Mg(OH)2的物质的量是![]() , Al(OH)3的物质的量是
, Al(OH)3的物质的量是![]() ,根据元素守恒,合金中金属铝的物质的量为0.01mol;
,根据元素守恒,合金中金属铝的物质的量为0.01mol;
(3)Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3的物质的量是0.01mol,则消耗氢氧化钠的物质的量是0.01mol,所以氢氧化钠的浓度是![]() =1mol/L,A点表示沉淀完全,溶液中的溶质是氯化钠,根据元素守恒,盐酸的物质的量为n(NaOH)=n(HCl)=1mol/L×0.055L=0.055mol,稀盐酸溶液的浓度为
=1mol/L,A点表示沉淀完全,溶液中的溶质是氯化钠,根据元素守恒,盐酸的物质的量为n(NaOH)=n(HCl)=1mol/L×0.055L=0.055mol,稀盐酸溶液的浓度为![]() 1.1mol/L。
1.1mol/L。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )
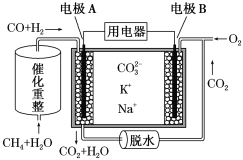
A.电池工作时,CO32-向电极B移动
B.电极B上发生的电极反应为O2+2CO2+4e-=2 CO32-
C.电极A上H2参与的电极反应为H2+2OH--2e-=2H2O
D.反应CH4+H2O 3H2+CO,每消耗1 mol CH4转移12 mol电子
3H2+CO,每消耗1 mol CH4转移12 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的锂氮二次电池,将可传递离子的醚类做电解质,电池的总反应(固氮过程)为6Li+N2=2Li3N。下列说法不正确的是( )
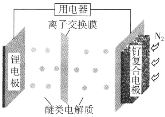
A.固氮时,阳极区发生反应Li-e-=Li+
B.脱氮过程,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C.醚类电解质可换成硫酸锂溶液
D.脱氮时,锂离子移向锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
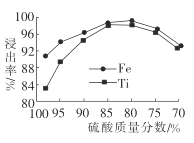
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2通入足量的氢氧化钠溶液,温度不同时充分反应后产物溶液中除大量OH-外,还有Cl-、ClO-、ClO3-,已知:Cl2+OH-→Cl-+ClO-+H2O(冷碱)、Cl2+OH-→Cl-+ClO3-+H2O(热碱),并知ClO-、ClO3-离子的物质的量比为2:1,试问原混合气体中Cl2与反应后溶液中的Cl-物质的量之比为( )
A.2:5B.3:1C.1:1D.5:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和条件被略去。A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;B、C、E是常见气体,G的焰色反应呈黄色;I的溶液呈黄色。

请回答下列问题:
(1)写出下列物质的化学式A___、F___、X___;
(2)说出黄绿色气体C的一种用途____;
(3)实验室检验H中所含的金属阳离子的方法是:___;
(4)写出Y和D溶液反应的离子方程式___;
(5)写出I与X溶液反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸金刚烷胺是一种治疗和预防病毒性感染的药物,可用于抑制病毒穿入宿主细胞,从结构上看是一种对称的三环状胺,可以利用环戊二烯(CPD)来制备合成,流程图如下:

(1)下列关于X和金刚烷说法正确的是_________
A.金刚烷和X互为同分异构体,均可以发生氧化反应和取代反应
B.金刚烷和X均可以使溴水褪色
C.金刚烷和X均具有与芳香烃相似的化学性质
D.金刚烷和X均不存在手性碳原子
(2)反应①的反应类型为____________,反应②的条件为________________。
(3)有机物Y的一氯代物的同分异构体的数目为___________,写出Y与氢氧化钠的乙醇溶液反应的化学方程式___________________________________。
(4)有机物Z是一种重要的有机氮肥,在核磁共振氢谱谱图中只有一个峰,写出Z与浓硫酸反应的化学方程式___________________________________。
(5)CPD可以与Br2的CC14溶液反应,写出其所有可能产物的结构简式_______________。
(6)参照上述流程图,并用流程图中出现的试剂和![]() 为原料合成
为原料合成 ,
,
设计其合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸[M(NOSO4H)=127g·mol-1]主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
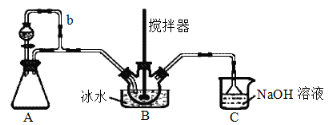
(1)装置A制取SO2,则A中反应的化学方程式为___,导管b的作用是___。
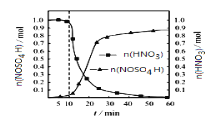
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。反应进行到10min后,反应速度明显加快,其可能的原因是___。
(3)装置C的主要作用是__。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
达到滴定终点时的现象为__,亚硝酰硫酸的纯度为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com