
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
【答案】D
【解析】
设X的最外层电子数为x,则Z和W的最外层电子数为(x+2)、(x+3),由X与Z的最高正价之和与W的相等可得,x+(x+2)=x+3,解得x=1,由此可知X为Na元素、Y 为Mg元素、Z为Al元素、W为C元素。
A.同周期元素,从左到右原子半径依次减小,同主族元素,从上到下原子半径依次增大,则原子半径:X>Y>Z>W,故A正确;
B. X2W2为Na2C2,Na2C2中含有离子键和共价键,故B正确;
C. Y 为Mg元素,氢氧化镁为难溶于水的氢氧化物,故C正确;
D. 将由Na、Al的单质组成的混合物放入冷水中,钠首先和水反应生成氢氧化钠和氢气,反应生成的氢氧化钠和铝单质反应生成偏铝酸钠和氢气,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)只含有离子键的是______(填序号,下同)
(2)含有共价键的离子化合物是______,其中含有非极性共价键的物质的电子式为______。
(3)属于共价化合物的是______。
(4)熔融状态下能导电的化合物是______。
(5)熔融状态下和固态时都能导电的物质是______。
(6)用电子式表示![]() 的形成过程:______。
的形成过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
B. 常温下,1LpH=11的NaOH溶液中由水电离出的H+的数目为10-11NA
C. 273K、101kPa下,22.4L由NO和O2组成的混合气体中所含分子总数为NA
D. 100g34%双氧水中含有H-O键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组物质性质的比较,结论正确的是(____________)
A. 分子的极性:![]() B. 物质的硬度:
B. 物质的硬度:![]()
C. 物质的沸点:![]() D.在
D.在![]() 中的溶解度:
中的溶解度:![]()
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)![]() 位于元素周期表中第四周期____族,基态
位于元素周期表中第四周期____族,基态![]() 原子核外未成对电子有_____个。
原子核外未成对电子有_____个。
(2)![]() 可与
可与![]() 反应生成
反应生成![]() ,新生成的化学键为_____键。
,新生成的化学键为_____键。![]() 分子的空间构型为______,其中N原子的杂化轨道类型为_______。
分子的空间构型为______,其中N原子的杂化轨道类型为_______。
(3)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm, ![]() 中锰的原子半径为_____pm。已知阿伏加德罗常数的值为
中锰的原子半径为_____pm。已知阿伏加德罗常数的值为![]() ,
, ![]() 的理论密度
的理论密度![]() ____
____![]() 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____,其配位数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___(填元素符号)。
(2)③的气态氢化物的电子式___,②④形成的气态化合物的结构式___。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为___(填物质的化学式),写出它的电子式:___;酸性最强的含氧酸为___(填物质的化学式),写出它的电离方程式:___。
(4)在②和③两种元素中,非金属性较强的是___(填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式___。
(5)②与Si元素分别形成的最高价氧化物,___的熔点更高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
A. 混合气体的压强 B. 气体的总物质的量
C. 混合气体的密度 D. 单位时间内生成n molC的同时消耗2n molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。
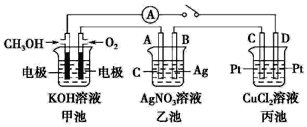
请回答下列问题:
(1)甲池为原电池,通入 CH3OH 电极的电极反应为________。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为_____。
(3)当乙池B极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池D极析出_____g 铜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com