
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
B. 常温下,1LpH=11的NaOH溶液中由水电离出的H+的数目为10-11NA
C. 273K、101kPa下,22.4L由NO和O2组成的混合气体中所含分子总数为NA
D. 100g34%双氧水中含有H-O键的数目为2NA
【答案】B
【解析】
A.Cl2通入NaOH溶液中发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,这是一个歧化反应,每消耗0.1molCl2转移电子数为0.1mol,A项错误;
B.碱溶液中的H+均是水电离产生的,pH等于11的NaOH溶液中水电离出的H+浓度为10-11mol/L,故1L该溶液中H+的数目为10-11mol,B项正确;
C.所给条件即为标准状况,首先发生反应:2NO+O2=2NO2,由于NO和O2的量未知,所以无法计算反应生成NO2的量,而且生成NO2以后,还存在2NO2![]() N2O4的平衡,所以混合气体中的分子数明显不是NA,C项错误;
N2O4的平衡,所以混合气体中的分子数明显不是NA,C项错误;
D.100g34%双氧水含有过氧化氢的质量为34g,其物质的量为1mol,含有H-O键的数目为2mol,但考虑水中仍有大量的H-O键,所以D项错误;
答案选择B项。


科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH===5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的个数之比为5∶1
C. Cl2既是氧化剂又是还原剂
D. 每生成1个氧化产物转移6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的AgNO3溶液滴定50.00mL0.0500mol/LKC1溶液,以K2CrO4为指示剂,测得溶液中pCl=-1gc(C1-)、pAg=-1gc(Ag+)随加入AgNO3溶液的体积变化如图所示。已知:Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,溶液中离子浓度小于或等于1.0×10-5mol/L则沉淀完全,下列说法错误的是

A. Ag2CrO4沉淀一定不是白色
B. AgC1的溶度积常数Ksp数量级为10-10
C. Cl-恰好完全沉淀时,指示剂的浓度应维持在2.0×10-2mol/L
D. 加入50 mLAgNO3溶液后再加入1mL0.01mol/LH2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应C(s)+O2(g) =CO2(g)来说,下列有关说法不正确的是( )
A. 增加木炭的物质的量,化学反应速率会加快
B. 升高温度,化学反应速率会加快
C. 将反应容器的体积缩小,化学反应速率会加快
D. 将木炭粉碎成粉末状,化学反应速率会加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
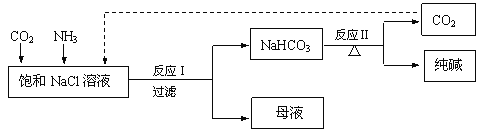
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:____________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_____________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是

A. 上层清液中,c(Ur-) = 7.0×10-2 mol·L-1
B. 在M→N 的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
C. 当c(HUr) = c(Ur-)时,c(Cl-)>c(Ur-)
D. 当pH=7 时,2c(Na+) = c(Ur-)+c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com