
【题目】下图是一个化学过程的示意图,回答下列问题:

(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃ 时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
【答案】(1)原电池 阳极 (2)CH4+10OH--8e-=CO32-+7H2O Ag++e-=Ag H2和NaOH
(3)12 HCl
【解析】
试题分析:(1)由图可看出甲图为燃料电池装置,是原电池,通入燃料的电极为负极。通入氧气的电极为正极。与电池的正极相连的电极A为阳极,与电池的负极相连的B电极为阴极。C为阳极,D为阴极。(2)甲装置中由于电解质为KOH溶液,是碱性的溶液。所以通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的电极反应式是O2+4e-+2H2O=4OH-.乙装置为电解池,在乙装置中A为阳极,B为阴极。B(Ag)的电极反应式为Ag++e-=Ag。丙装置为电解池, C为阳极,D为阴极。由于氧化性H+>Na+,所以在D极上发生反应:2H++2e-=H2↑.由于消耗了H+,破坏了附近的水的电离平衡,水继续电离,最终在阴极附近产生大量的NaOH溶液。故D极的产物是H2和NaOH。(3)在丙中,阳极反应:2Cl-+2e-=Cl2↑;阴极反应:2H++2e-=H2↑,n(气体)=0.112L÷22.4L/mol=0.005mol.所以转移电子的物质的量为n(e-)=0.005mol. n(OH-)=0.005mol , C(OH-)=0.005mol÷0.5L=0.01mol/L, C(H+)=10-14÷0.01 =10-12mol/l,PH=12.NaOH+HCl=NaCl+H2O,n(NaOH)=n(HCl)=0.005mol.所以若要使丙池恢复电解前的状态,应向丙池中通入HCl气体0.005mol.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机玻璃的单体分子(只含C、H、O元素)结构模型如图所示。下列分析正确的是
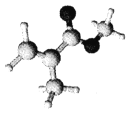
A. 该分子所有原子可能共面 B. 与该单体互为同分异构体的羧酸类有4种
C. 该有机高分子的链节为 D. 该有机玻璃容器可贮存强酸强碱溶液
D. 该有机玻璃容器可贮存强酸强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年,宿迁市成功创建为全国文明卫生城市,城市生态环境明显改善。
①下列做法不利于改善空气质量的是_________。
a.工厂通过静电除尘减少悬浮颗粒物排放
b.以新能源公交车代替燃油公交车
c.夜间排放工业废气
② 公共场所安装直饮水设备,方便市民饮用。直饮水需要经过活性炭处理、超滤膜过滤、紫外灯照射等处理过程。其中活性炭作为_________。
a. 混凝剂 b. 吸附剂 c.杀菌、消毒剂
③ 宿迁40余处“落叶景观带”成为扮靓城市的秋冬美景,为保护落叶景观带设置的“严禁烟火”标志是_________。

a b c
(2)红薯含有丰富的淀粉、膳食纤维、胡萝卜素、维生素A、B、C、E以及钾、铁、钙等多种营养成分,是一种营养均衡的保健食品。
① 红薯中含有的_________可有效改善牙龈出血。
a.维生素A b.维生素B c.维生素C
② 以上成分中,_________(填元素符号)为人体必需的微量元素。
③ 红薯中含有丰富的淀粉,其在人体内完全水解的最终产物是____(填化学式)。实验室检验该水解产物所用的试剂是_________。
④ 红薯不宜过多食用,否则会产生较多胃酸。双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为:__________。
(3)2017年,世界最长的跨海大桥——港珠澳跨海大桥正式通车。建造大桥使用了大量钢材、水泥、玻璃、光导纤维、橡胶等材料。

① 工业上生产水泥、玻璃都用到的原料是_________。
② 深埋在海水中的钢管桩易发生_______腐蚀,下列保护钢管桩的措施不合理的是________。
a.使用抗腐蚀性强的合金钢
b.在钢材表面喷涂防腐涂料
c.钢管桩附着铜以增强抗腐蚀性
③ 港珠澳大桥工程使用了大量密封橡胶衬垫。为使橡胶性能更好,天然橡胶需经过__________处理以增强其机械性能。
④ 光导纤维是由高纯度SiO2于2000℃下拉制而成,工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,该反应的化学方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是

A.该反应的热化学方程式为 :A(g )+3B(g)![]() 2C(g);△H>0
2C(g);△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。
①三种溶液pH由大到小的顺序为:__________________填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)____c(CO32-) (填“>”、“<”或“=”)。
(2)已知25℃时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是________ 。 (填写序号);b中氯离子的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
实验装置 | 实验序号 | 电极材料 | 实验现象 |
| ① | 铂 | 两极均产生大量无色气泡, 两极区的溶液均未见白色浑浊 |
② | 石墨 | 两极均产生大量无色气泡, 阴极区未见白色浑浊, 阳极区产生白色浑浊,分离出该白色固体,加酸溶解,产生气泡 |
根据实验现象,下列说法正确的是
A. ①②中,阴极的电极反应式:2H2O-4e == O2↑+ 4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于pH=3的CH3COOH溶液的叙述正确的是
A. 溶液中H2O电离出的c(OH)=1.0×103 mol·L1
B. 加入少量CH3COONa固体后,溶液pH升高
C. 加0.1 mol·L1 CH3COONa溶液使pH>7,则c(CH3COO)=c(Na+)
D. 与等体积pH=11的NaOH溶液混合,所得溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质,根据要求填空:
![]() 晶体
晶体 ![]() 3
3 ![]() 葡萄糖
葡萄糖![]()
![]() 液态醋酸
液态醋酸 ![]()
![]() 澄清石灰水
澄清石灰水 ![]() 熔融的
熔融的![]() 氨水
氨水 ![]() 固体
固体![]() 石墨
石墨
(1)能导电的物质是______;![]() 填序号,下同
填序号,下同![]()
(2)属于强电解质的是______;
(3)属于弱电解质的是______;
(4)属于非电解质的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com