
【题目】某有机玻璃的单体分子(只含C、H、O元素)结构模型如图所示。下列分析正确的是
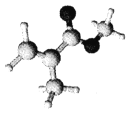
A. 该分子所有原子可能共面 B. 与该单体互为同分异构体的羧酸类有4种
C. 该有机高分子的链节为 D. 该有机玻璃容器可贮存强酸强碱溶液
D. 该有机玻璃容器可贮存强酸强碱溶液
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A. 利用金属钠或者金属钾 B. 利用质谱法
C. 利用红外光谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在强酸性溶液中能大量共存的是( )
A.K+、Na+、HCO3﹣、SO42﹣
B.Na+、Fe3+、I﹣、CI﹣
C.Na+、NH4+、NO3﹣、CI﹣
D.Na+、Ba2+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于________(填字母)。

A.交叉分类法
B.树状分类法
(2)人们以_________________________________为分类标准分出溶液、胶体和浊液三种体系,请写出实验室制备Fe(OH)3胶体的化学方程式:______________________________;
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ____________ | ___________ | ___________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于人造地球卫星的一种高能电池——银锌蓄电池,其电极式反应式为Zn+2OH--2e-======ZnO+H2O Ag2O+H2O+2e-======2Ag+2OH-。据此判断氧化银是
A. 负极,并被氧化 B. 正极,并被还原
C. 负极,并被还原 D. 正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】载人空间站为了循环利用人体呼出的CO2并将其转化为O2,设计装置工作原理如图所示,以实现“太阳能能→电能→化学能”的转化。总反应为2CO2=2CO+O2。下列说法正确的是
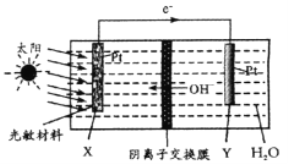
A. 该装置属于原电池 B. 水在Y电极参与反应
C. 反应完毕,该装置中电解质溶液碱性增强 D. X极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
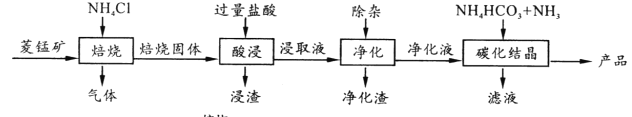
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
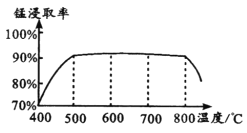
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图,回答下列问题:

(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃ 时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com