
【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于________(填字母)。

A.交叉分类法
B.树状分类法
(2)人们以_________________________________为分类标准分出溶液、胶体和浊液三种体系,请写出实验室制备Fe(OH)3胶体的化学方程式:______________________________;
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ____________ | ___________ | ___________ | __________ |
【答案】B 分散质粒子大小 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl H2S NH3·H2O NH4HSO4(或NH4HSO4 、NH4HS) SO2(或SO3、N2O5、N2O3)
Fe(OH)3(胶体)+3HCl H2S NH3·H2O NH4HSO4(或NH4HSO4 、NH4HS) SO2(或SO3、N2O5、N2O3)
【解析】
(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,之间为包含关系;(2)溶液、胶体和浊液的本质区别是分散质粒子直径的大小不同;根据制备氢氧化铁胶体的原理书写方程式;(3)根据酸、碱、盐及氧化物的概念写出以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质;据此分析解答。
(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,图示方法就是树状分类图,故答案为:B;
(2)溶液、胶体和浊液的本质区别是分散质粒子直径的大小不同,实验室利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,故答案为:分散质粒子大小;FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,故答案为:分散质粒子大小;FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(3)由H、O、S、N、几种元素中的两种或者三种元素:组成的非含氧酸有H2S;组成的碱有NH3·H2O;组成的酸式盐有NH4HSO4、NH4HSO4 、NH4HS,组成的酸性氧化物有SO2、SO3、N2O5、N2O3,故答案为:H2S;NH3·H2O;NH4HSO4(或NH4HSO4、NH4HS);SO2(或SO3、N2O5、N2O3)。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是
A. 常温下溶解度:Na2CO3<NaHCO3
B. 热稳定性:Na2CO3<NaHCO3
C. 与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D. 与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最终没有固体析出的是( )
A.向NaHCO3溶液中加入过量澄清石灰水
B.向饱和氢氧化钠溶液中加入钠单质
C.向氯化钡溶液中通入少量SO2
D.向饱和碳酸钠溶液中通入过量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________。
(2)基态Mn原子的价电子排布式为_________,未成对电子数为_____个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____,该分子中碳原子的杂化方式为_______;C、H、N的电负性从大到小的顺序为________。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________。
(6)某种含锰特殊材料的晶胞结构如下图所示:
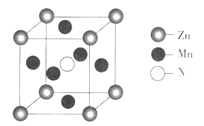
若晶胞参数为anm,用NA表示阿伏加德罗常数的值,则该晶胞的密度为____(列出代数式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机玻璃的单体分子(只含C、H、O元素)结构模型如图所示。下列分析正确的是
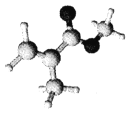
A. 该分子所有原子可能共面 B. 与该单体互为同分异构体的羧酸类有4种
C. 该有机高分子的链节为 D. 该有机玻璃容器可贮存强酸强碱溶液
D. 该有机玻璃容器可贮存强酸强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是

A.该反应的热化学方程式为 :A(g )+3B(g)![]() 2C(g);△H>0
2C(g);△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com