
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
【答案】 三(或3) VIA 1s22s22p4 ![]() O>S(或S<O) NH3<H2O (或H2O>NH3) 范德华力、氢键 NH4HSO4
O>S(或S<O) NH3<H2O (或H2O>NH3) 范德华力、氢键 NH4HSO4 ![]() 2K2O2+2CO2=2K2CO3+O2 Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O(3分) (表示为HSO3- 与Cr O72-反应也可)
2K2O2+2CO2=2K2CO3+O2 Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O(3分) (表示为HSO3- 与Cr O72-反应也可)
【解析】A为第二周期中一种非金属元素,第一电离能大于相邻元素,则A为N元素,B是地壳中含量最多的元素,2P轨道上有二个孤电子,所以B为O元素,D为前四周期中金属性最强的元素,D为K元素,C与B同主族,且原子序数小于K元素,所以C为S元素,E是前四周期中原子核外孤电子数最多的元素,则E为Cr元素。
(1) .C是S元素,位于元素周期表的第3周期VIA族,B是O元素,核外电子排布式为1s22s22p4,E是Cr元素,价电子排布图为![]() ,故答案为:3;VIA;1s22s22p4;
,故答案为:3;VIA;1s22s22p4;![]() ;
;
(2) .元素的非金属性越强,该元素的电负性越强,因非金属性O>S,则两元素的电负性大小关系为:O>S,元素的非金属性越强,其对应的最简单气态氢化物越稳定,因非金属性O>N,则两元素的最简单气态氢化物的稳定性强弱大小关系为:NH3<H2O,故答案为:O>S;NH3<H2O;
(3) .H2O是分子晶体,因O元素的非金属性强,水分子之间存在氢键,则水由固体变为气态时需要克服的微粒间的作用力有范德华力和氢键,故答案为:范德华力、氢键;
(4) .N、O、S三种元素及氢元素组成的既含离子键又含共价键的化合物中应含有铵根离子,S元素的最高正价为+6,则由这四种元素形成的酸式盐的化学式为NH4HSO4,故答案为:NH4HSO4;
(5) .K2O2的电子式为:![]() ,与CO2反应生成O2的化学方程式为:2K2O2+2CO2=2K2CO3+O2,故答案为:
,与CO2反应生成O2的化学方程式为:2K2O2+2CO2=2K2CO3+O2,故答案为:![]() ;2K2O2+2CO2=2K2CO3+O2;
;2K2O2+2CO2=2K2CO3+O2;
(6) .Cr2O72-具有强氧化性,S元素呈+4价的还原性离子为SO32-或HSO3-,根据得失电子守恒和原子守恒,在酸性条件下该反应的离子方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O或Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O,故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O或Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
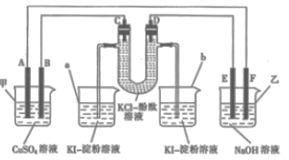
(1)甲池是________(填“原电池”或“电解池”,下同)装置;乙池是________装置。
(2)C极为________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_________________(填“a”或“b”)。
(4)C极上的电极反应式为___________________________________。
(5)甲池中反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于________(填字母)。

A.交叉分类法
B.树状分类法
(2)人们以_________________________________为分类标准分出溶液、胶体和浊液三种体系,请写出实验室制备Fe(OH)3胶体的化学方程式:______________________________;
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ____________ | ___________ | ___________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】载人空间站为了循环利用人体呼出的CO2并将其转化为O2,设计装置工作原理如图所示,以实现“太阳能能→电能→化学能”的转化。总反应为2CO2=2CO+O2。下列说法正确的是
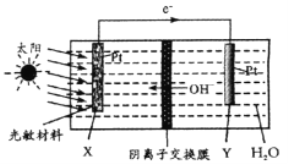
A. 该装置属于原电池 B. 水在Y电极参与反应
C. 反应完毕,该装置中电解质溶液碱性增强 D. X极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
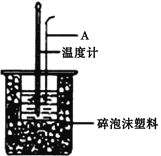
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
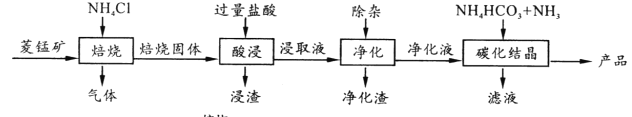
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
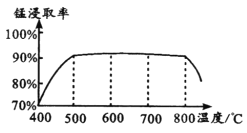
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。A的摩尔质量为80g/mol, B、D、H、J均为气体,B能使湿润的红色石蕊试液变蓝,D在空气中含量最多,H是一种无色、刺激性气味气体,C是一种紫红色金属单质, I是一种淡黄色固体。E是最常见的一种无色液体。

(1)A的化学式为_________。
(2)固体K的电子式为_________。
(3)反应②的化学方程式:_________。
(4)反应③的离子方程式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com