
【题目】(1)2017年,宿迁市成功创建为全国文明卫生城市,城市生态环境明显改善。
①下列做法不利于改善空气质量的是_________。
a.工厂通过静电除尘减少悬浮颗粒物排放
b.以新能源公交车代替燃油公交车
c.夜间排放工业废气
② 公共场所安装直饮水设备,方便市民饮用。直饮水需要经过活性炭处理、超滤膜过滤、紫外灯照射等处理过程。其中活性炭作为_________。
a. 混凝剂 b. 吸附剂 c.杀菌、消毒剂
③ 宿迁40余处“落叶景观带”成为扮靓城市的秋冬美景,为保护落叶景观带设置的“严禁烟火”标志是_________。

a b c
(2)红薯含有丰富的淀粉、膳食纤维、胡萝卜素、维生素A、B、C、E以及钾、铁、钙等多种营养成分,是一种营养均衡的保健食品。
① 红薯中含有的_________可有效改善牙龈出血。
a.维生素A b.维生素B c.维生素C
② 以上成分中,_________(填元素符号)为人体必需的微量元素。
③ 红薯中含有丰富的淀粉,其在人体内完全水解的最终产物是____(填化学式)。实验室检验该水解产物所用的试剂是_________。
④ 红薯不宜过多食用,否则会产生较多胃酸。双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为:__________。
(3)2017年,世界最长的跨海大桥——港珠澳跨海大桥正式通车。建造大桥使用了大量钢材、水泥、玻璃、光导纤维、橡胶等材料。

① 工业上生产水泥、玻璃都用到的原料是_________。
② 深埋在海水中的钢管桩易发生_______腐蚀,下列保护钢管桩的措施不合理的是________。
a.使用抗腐蚀性强的合金钢
b.在钢材表面喷涂防腐涂料
c.钢管桩附着铜以增强抗腐蚀性
③ 港珠澳大桥工程使用了大量密封橡胶衬垫。为使橡胶性能更好,天然橡胶需经过__________处理以增强其机械性能。
④ 光导纤维是由高纯度SiO2于2000℃下拉制而成,工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,该反应的化学方程式为:_________。
【答案】 c b a c Fe C6H12O6 新制Cu(OH)2 或银氨溶液 NaAl(OH)2CO3 + 4HCl=NaCl + AlCl3 + 3H2O + CO2↑ 石灰石或CaCO3 电化学或吸氧 c 硫化 SiCl4 + O2 ![]() SiO2 + 2Cl2
SiO2 + 2Cl2
【解析】(1) ①a、可减少颗粒状污染物的排放,b、可减少碳氧化物、氮氧化物的排放,所以a、b都能改善空气质量,c、任何时候排放过量的或有污染空气的工业废气都会造成空气污染,故c不利于改善空气质量。正确答案为c;②活性炭具有吸附性,使饮用水得到净化,活性炭没有强氧化性或杀菌消毒作用,也没有凝结的作用,所以正确答案为b;③图a是“严禁烟火”标志,图b是禁止随意扔垃圾标志,图c是严禁摘花标志,所以正确答案为a;
(2) ①牙龈出血是由于缺少维生素C引起的,故正确答案为c;②在这些物质成分中,为人体必需的微量元素是铁;③淀粉水解的最终产物是葡萄糖,化学式为C6H12O6,由于葡萄糖分子结构中含有—CHO,所以实验室检验的试剂有银氨溶液或新制的Cu(OH)2浊液;④双羟基铝碳酸钠[NaAl(OH)2CO3]与胃酸(HCl)反应的化学方程式为NaAl(OH)2CO3 + 4HCl= NaCl + AlCl3 + 3H2O + CO2↑;
(3) ①工业上生产水泥的原料是石灰石和黏土,生产玻璃的原料是石灰石、纯碱和石英,所以二者都用到的原料是石灰石;②海水中含有电解质,钢管里含有极少量杂质碳等,所以深埋在海水中的钢管桩易发生电化腐蚀;使用抗腐蚀性强的合金钢可以减少这种腐蚀,故a合理;在钢材表面喷涂防腐涂料可防止与海水接触,减少腐蚀,b也合理;c、由于铁比铜活泼,所以在钢管桩附着铜,使铁作负极,失去电子而加速腐蚀,故c不合理。正确答案为c;③天然橡胶分子结构中含有碳碳双键,易被氧化而变质、老化等,所以要经过硫化处理以增强其性能;④根据叙述可知反应物为SiCl4和O2,生成物为SiO2,由质量守恒可写出该反应的化学方程式为SiCl4 + O2 ![]() SiO2 + 2Cl2。
SiO2 + 2Cl2。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在强酸性溶液中能大量共存的是( )
A.K+、Na+、HCO3﹣、SO42﹣
B.Na+、Fe3+、I﹣、CI﹣
C.Na+、NH4+、NO3﹣、CI﹣
D.Na+、Ba2+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】载人空间站为了循环利用人体呼出的CO2并将其转化为O2,设计装置工作原理如图所示,以实现“太阳能能→电能→化学能”的转化。总反应为2CO2=2CO+O2。下列说法正确的是
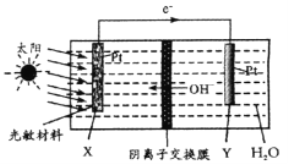
A. 该装置属于原电池 B. 水在Y电极参与反应
C. 反应完毕,该装置中电解质溶液碱性增强 D. X极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
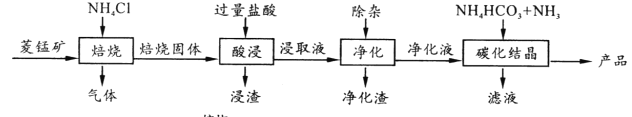
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
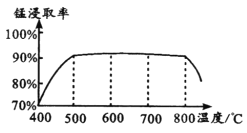
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。A的摩尔质量为80g/mol, B、D、H、J均为气体,B能使湿润的红色石蕊试液变蓝,D在空气中含量最多,H是一种无色、刺激性气味气体,C是一种紫红色金属单质, I是一种淡黄色固体。E是最常见的一种无色液体。

(1)A的化学式为_________。
(2)固体K的电子式为_________。
(3)反应②的化学方程式:_________。
(4)反应③的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
A. 电池工作时OH―向负极迁移 B. 正极反应式为2FeO42-+10H++6e―=Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变 D. 电子由Zn电极流出,经KOH溶液流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图,回答下列问题:

(1)甲池是 装置,电极A的名称是 。
(2)甲装置中通入CH4的电极反应式为 ,乙装置中B(Ag)的电极反应式为 ,丙装置中D极的产物是 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃ 时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入 (写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com