
【题目】臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H= ____kJmol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4molL-1SO3,此时SO2的转化率为_______,欲提高O3的利用率可采取的措施有_______(填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______molNa2SO4。
 ,
,
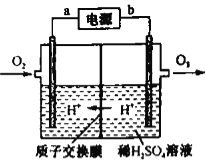
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____极,通入O2的电极反应式为_______。
【答案】![]() 减少氮氧化物的排放或减少氟氯烃的使用等 -241.1 40% d 6.1 负极 O2+4e-+4H+=2H2O
减少氮氧化物的排放或减少氟氯烃的使用等 -241.1 40% d 6.1 负极 O2+4e-+4H+=2H2O
【解析】
(1)根据盖斯定律,可知反应①+②-③可得目标反应2O3=3O2,则化学方程式相加减,化学平衡向乘数,2O3=3O2的平衡常数![]() ;O3在NOx的作用下会发生分解生成氧气,保护臭氧层,可以减少NOx的排放,或者减少氟氯烃的使用等;
;O3在NOx的作用下会发生分解生成氧气,保护臭氧层,可以减少NOx的排放,或者减少氟氯烃的使用等;
(1)①根据盖斯定律,![]() (反应①-反应②)可得目标反应SO2(g)+O3(g)=SO3(g)+O2(g),则△H=
(反应①-反应②)可得目标反应SO2(g)+O3(g)=SO3(g)+O2(g),则△H=![]() (-198-284.2)kJ·mol-1=-241.1kJ·mol-1;
(-198-284.2)kJ·mol-1=-241.1kJ·mol-1;
②达到平衡后,容器中SO3的浓度为0.4mol·L-1,则生成SO3的物质的量n=0.4mol·L-1×2L=0.8mol,根据化学方程式,生成0.8molSO3需要消耗0.8molSO2,则SO2的转化率![]() ;
;
欲提高O3的利用率,a.适当增大压强,该反应是反应前后气体体积不变的反应,增大压强平衡不移动,O3的利用率不变,a不符合题意;b.升高温度,该反应为放热反应,升高温度,平衡逆向移动,O3的转化率降低,b不符合题意;c.使用优质催化剂,催化剂可以加快化学反应速率,但是不影响平衡移动,O3的利用率不变,c不符合题意;d.及时分离SO3,促进平衡正向移动,O3的利用率增大,d符合题意;答案选d;
(3)根据题意,CaSO3悬浊液中加入Na2SO4,发生反应,CaSO3(s)+SO42-(aq)![]() =CaSO4(s)+SO32-(aq),该反应的平衡常数
=CaSO4(s)+SO32-(aq),该反应的平衡常数![]() ,0.1molCaSO3参与反应,生成CaSO4的物质的量为0.1mol,则沉淀消耗Na2SO4的物质的量为0.1mol;溶液中含有的SO32-的物质的量为0.1mol,其物质的量浓度
,0.1molCaSO3参与反应,生成CaSO4的物质的量为0.1mol,则沉淀消耗Na2SO4的物质的量为0.1mol;溶液中含有的SO32-的物质的量为0.1mol,其物质的量浓度![]() ,根据平衡常数可知,
,根据平衡常数可知,![]() ,则溶液中的c(SO42-)=6mol·L-1。为了维持溶液中的c(SO42-)=6mol·L-1,需要消耗Na2SO4的物质的量n=6mol·L-1×1L=6mol,则总共消耗Na2SO4的物质的量为0.1mol+6mol=6.1mol;
,则溶液中的c(SO42-)=6mol·L-1。为了维持溶液中的c(SO42-)=6mol·L-1,需要消耗Na2SO4的物质的量n=6mol·L-1×1L=6mol,则总共消耗Na2SO4的物质的量为0.1mol+6mol=6.1mol;
(4)根据图示,利用电解法制取O3,H+由右侧经质子交换膜向左侧移动;在电解池中,阳离子向阴极移动,则左侧为阴极区,a为电源的负极。在酸性电解质溶液中,O2得到电子生成H2O,则电解方程式为O2+4e-+4H+=2H2O。


科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
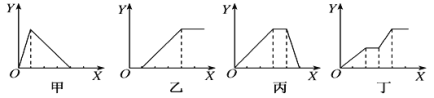
A.丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
B.丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
C.乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D.甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O
C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+
D.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.10mol·L-1CuSO4溶液480mL。
①配制溶液时必需的仪器有:托盘天平(精确到0.1)、药匙、烧杯、玻璃棒、______、胶头滴管以及等质量的几片滤纸。
②配制该溶液需称取CuSO4·5 H2O晶体的质量为_______。
③下列操作会使所配溶液浓度偏低的是________。
A.容量瓶洗涤干净后未干燥
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.定容时俯视刻度线
D.烧杯和玻璃棒未洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁能在二氧化碳中燃烧:2Mg+CO2![]() 2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
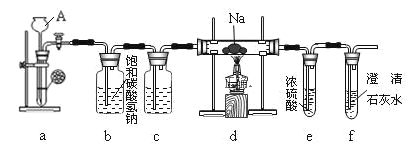
请回答下列问题:
(1)装置a中发生的是实验室制CO2的反应,反应方程式为___。
(2)装置b中发生反应的离子方程式为___,装置c的作用为___。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是___。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸, 溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300 mL 1 mol·L-1的稀硝酸中,加入5.6 g铁粉,充分反应后,铁粉全部溶解(假设还原产物只有NO),下列说法不正确的是( )
A. 最终所得溶液中既有Fe2+又有Fe3+
B. 最终溶液中,硝酸无剩余
C. 标准状况下生成NO的体积为1.68 L
D. 再向最终所得溶液中滴加稀硝酸,无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快速平衡)
2I(g)(快速平衡)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列说法错误的是( )
A.升高温度,第一步向右进行的程度变大
B.第二步的活化能大于第三步的活化能
C.总反应为2N2O![]() 2N2+O2
2N2+O2
D.c[IO(g)]对总反应速率的影响大于c[I(g)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列反应电子转移的方向和总数:
2Fe(NO3)3 + 16NaOH + 3Cl2 → 2Na2FeO4 + 6NaNO3 + 6NaCl + 8H2O________________
(1)反应中______元素被氧化, 还原剂是__________, 还原产物是_______,发生还原反应的物质是_________
(2)若反应中转移了0.2 mol电子,则消耗了_______L Cl2(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
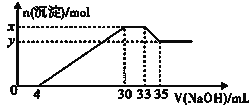
A.x-y=0.01molB.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/LD.原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com