
【题目】碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快速平衡)
2I(g)(快速平衡)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列说法错误的是( )
A.升高温度,第一步向右进行的程度变大
B.第二步的活化能大于第三步的活化能
C.总反应为2N2O![]() 2N2+O2
2N2+O2
D.c[IO(g)]对总反应速率的影响大于c[I(g)]
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
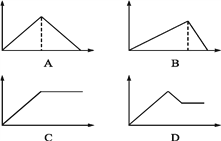
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长余辉材料在发光照明、交通等领域具有广泛的应用前景。下图是一种利用大理石(主要成分CaCO3和MgCO3)和铝土矿(主要成分Al2O3,还含少量Fe2O3杂质)制备一种长余辉材料(Ca12Al14Ox)的工艺流程图。回答下列问题:
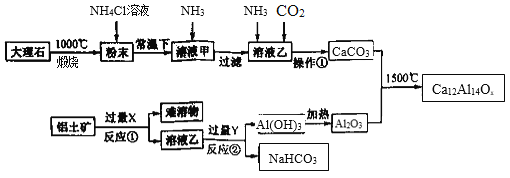
(1)Ca12Al14Ox中x的数值为 ______,试剂X的名称是_________。
(2)NH4Cl溶液能溶解“粉末”的原因是_________,发生的主要反应的化学方程为______。
(3)反应②的离子方程式为 _______。
(4)实验室加热Al(OH)3应在________(填仪器名称)进行;操作①包括_____、干燥等。
(5)若溶液甲中c(Mg2+) <5×10-5molL-1元素损失,此时应调节溶液pH大于______,为减少钙元素损失,应控制溶液甲中c(Ca2+)≤______。常温下Ksp[Mg(OH)2]=5×10-11,Ksp[Ca(OH)2]=5×10-6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H= ____kJmol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4molL-1SO3,此时SO2的转化率为_______,欲提高O3的利用率可采取的措施有_______(填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______molNa2SO4。
 ,
,
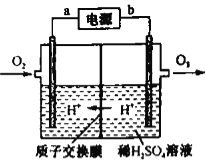
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____极,通入O2的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中正确的是
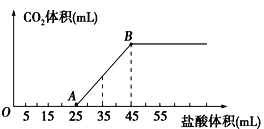
A.OA段发生反应的离子方程式为:H++OH-=H2O
B.当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。椐图回答:
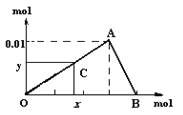
(1)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是________________,由此可得A点的坐标为_______;
(2)当C点从A点向B点运动时,表示:_____。AB曲线表示的离子反应为:______,由此可得B点的坐标为:__________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列说法正确的是( )
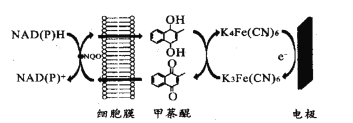
A.图中所示电极为阳极,其电极反应式为K4Fe(CN6)-e-=K3Fe(CN)6
B.甲荼醌在阴极发生氧化反应
C.工作时K+向图中所示电极移动
D.NAD(P)H转化为NAD(P)+的过程失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
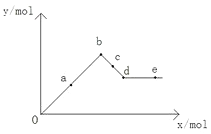
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:Ba2+比AlO2-多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com