
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中正确的是
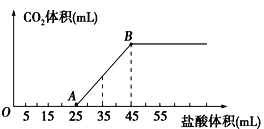
A.OA段发生反应的离子方程式为:H++OH-=H2O
B.当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
【答案】B
【解析】
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-,A错误;
B.AB段发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,根据方程式n(CO2)=(35-25)×10-3L×1mol/L=0.01mol,所以二氧化碳的体积V(CO2)=0.01mol×22.4L/mol=0.224L=224mL,B正确;
C.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-,所以A点的溶质为NaC1、NaHCO3,C错误;
D.由反应HCO3-+H+=H2O+CO2↑,n(CO2)=n(Na2CO3)=(45-25)×10-3×1=0.02mol,所以氢氧化钠的质量为m(NaOH)=2.32g-0.02×106g=0.2g,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】盐酸金刚烷胺是一种治疗和预防病毒性感染的药物,可用于抑制病毒穿入宿主细胞,从结构上看是一种对称的三环状胺,可以利用环戊二烯(CPD)来制备合成,流程图如下:

(1)下列关于X和金刚烷说法正确的是_________
A.金刚烷和X互为同分异构体,均可以发生氧化反应和取代反应
B.金刚烷和X均可以使溴水褪色
C.金刚烷和X均具有与芳香烃相似的化学性质
D.金刚烷和X均不存在手性碳原子
(2)反应①的反应类型为____________,反应②的条件为________________。
(3)有机物Y的一氯代物的同分异构体的数目为___________,写出Y与氢氧化钠的乙醇溶液反应的化学方程式___________________________________。
(4)有机物Z是一种重要的有机氮肥,在核磁共振氢谱谱图中只有一个峰,写出Z与浓硫酸反应的化学方程式___________________________________。
(5)CPD可以与Br2的CC14溶液反应,写出其所有可能产物的结构简式_______________。
(6)参照上述流程图,并用流程图中出现的试剂和![]() 为原料合成
为原料合成 ,
,
设计其合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸[M(NOSO4H)=127g·mol-1]主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
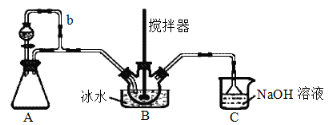
(1)装置A制取SO2,则A中反应的化学方程式为___,导管b的作用是___。
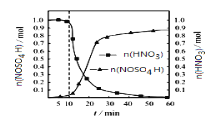
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。反应进行到10min后,反应速度明显加快,其可能的原因是___。
(3)装置C的主要作用是__。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
达到滴定终点时的现象为__,亚硝酰硫酸的纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁能在二氧化碳中燃烧:2Mg+CO2![]() 2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
2MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
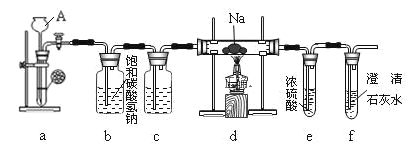
请回答下列问题:
(1)装置a中发生的是实验室制CO2的反应,反应方程式为___。
(2)装置b中发生反应的离子方程式为___,装置c的作用为___。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是___。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸, 溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化苯(基)硒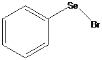 有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
(1)Br原子核外能量高的能层符号是__________,其基态原子价电子排布式为_______。
(2)C、N、O三种原子的第一电离能由大到小的顾序为_______。
(3)乙酸分子中碳原子的杂化方式为_______。
(4) H2Se的沸点_______(填“>”“<”或“=”)H2S,原因是_______。
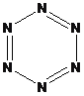
(5)晶体氮(N6)的结构如下图所示,其熔点为70℃,晶体氮中存在的作力有_______。
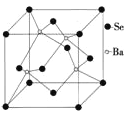
(6)BaSe可用于光电池,其晶胞结构如上图所示,晶胞参数a=0.786nm,NA代表阿伏加徳罗常数,列式计算BaSe晶胞密度为____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快速平衡)
2I(g)(快速平衡)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列说法错误的是( )
A.升高温度,第一步向右进行的程度变大
B.第二步的活化能大于第三步的活化能
C.总反应为2N2O![]() 2N2+O2
2N2+O2
D.c[IO(g)]对总反应速率的影响大于c[I(g)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
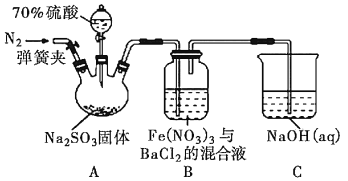
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO![]()
B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
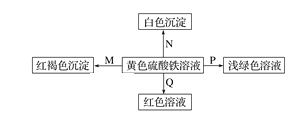
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com