
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
【答案】(1)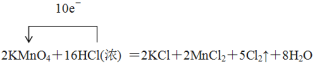
(2)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(3)②(4)1;6.02×1023
(5)16H+;8H2O;C2O42-;22.4
【解析】
试题分析:(1)反应中Mn元素的化合价从+7价降低到+2价,得到5个电子,盐酸中氯元素的化合价从-1价升高到0价,失去1个电子,所以配平后的方程式为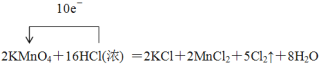 。
。
(2)该反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)反应中氯元素的化合价升高,盐酸贝氧化,作还原剂。另外还有氯化锰生成,因此还起到酸性的作用,答案选②;
(4)若产生0.5molCl2,则根据氯原子守恒可知被氧化的HCl是1mol,转移的电子的数目约为6.02×1023。
(5)反应中Mn元素的化合价从+7价降低到+2价,得到5个电子,草酸中碳元素的化合价从+3价升高到+4价,失去1个电子,所以配平后的方程式为2MnO4-+5C2O42-+16H+=2Mn2+ +10CO2↑+8H2O;此反应中,发生氧化反应的物质是C2O42-;若转移1mol电子,生成标准状况下CO2的体积为1mol×22.4L/mol=22.4L。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.x∶y等于甲与乙的相对分子质量之比
B.y∶x等于同温同体积下等质量的甲与乙的压强之比
C.x∶y等于同温同压下甲与乙的密度之比
D.x∶y等于等质量的甲与乙的分子个数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素,金属性或非金属性强弱比较正确的是
A. 金属性:Na>K B. 非金属性:O>S C. 金属性:Mg<Al D. 非金属性:F<Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荆门天茂实业集团为新能源领域的先行者,在中南地区拥有最大的甲醇装置并已建成年产50万吨二甲醚装置。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及如下反应。
甲醇合成反应:(i)CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.1kJmol-1
CH3OH(g)△H1=-90.1kJmol-1
二甲醚合成反应:(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-23.9kJmol-1
CH3OCH3(g)+H2O(g)△H2=-23.9kJmol-1
(iii)2CH3OH(g)![]() C2H4(g)+2H2O(g)△H3=-29.1kJmol-1
C2H4(g)+2H2O(g)△H3=-29.1kJmol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上以铝土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示) 、 、2Al(OH)3 ![]() Al2O3 +3H2O。
Al2O3 +3H2O。
(2)一定温度时,反应(i)的平衡常数数值Kp = 4.80×10-2,向容器中充入2 mol H2和1 molCO,反应(i)达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为__________(Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(3)二甲醚合成反应过程中两反应能量变化如图所示:

①反应速率较大的是__________(填序号 “ ii”、“ iii”),说明原因 。
②若在容器中加入催化剂,则E2 - E1将__________(填“变大”、“不变”或“变小”)。
(4)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.叠氮酸(HN3)与醋酸酸性相近,0.1 mol·L-1NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH![]() )=c(Cl-)
)=c(Cl-)
D.0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:
2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列表述不正确的是( )
A.严禁乱弃废电池,防止重金属污染土壤和水源
B.皮肤沾有油脂时,立即用氢氧化钠稀溶液擦洗
C.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
D.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是指直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是
A.能全部透过半透膜 B.有丁达尔效应
C.所得溶液一定能导电 D.所得物质一定为悬浊液或乳浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com