
【题目】同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.x∶y等于甲与乙的相对分子质量之比
B.y∶x等于同温同体积下等质量的甲与乙的压强之比
C.x∶y等于同温同压下甲与乙的密度之比
D.x∶y等于等质量的甲与乙的分子个数之比
【答案】D
【解析】
试题分析:同温同压下,气体的Vm相同,xg的甲气体和yg的乙气体占有相同的体积,由n=![]() 可知甲乙两种气体的物质的量相同,则A.气体的物质的量相同,由m=nM可知x:y等于甲与乙的相对分子质量之比,A正确;B.同温同体积下等质量的甲与乙的物质的量与摩尔质量成反比,因此物质的量的比n(甲):m(乙)=y:x,气体的物质的量越多,则气体产生的压强就越大,因此两种气体的压强之比为y:x,B正确;C.由于气体的密度是单位体积内气体的质量,两种气体的体积相同,质量之比为x;y,则密度之比为x:y,正C确;D.由于M(甲):M(乙)=x:y,等质量的甲与乙的分子个数之比应等于二者的物质的量的比,N(甲):N(乙)=[m/ M(甲)]: [m/ M(乙)]= M(乙): M(甲)=y:x;D错误,答案选D。
可知甲乙两种气体的物质的量相同,则A.气体的物质的量相同,由m=nM可知x:y等于甲与乙的相对分子质量之比,A正确;B.同温同体积下等质量的甲与乙的物质的量与摩尔质量成反比,因此物质的量的比n(甲):m(乙)=y:x,气体的物质的量越多,则气体产生的压强就越大,因此两种气体的压强之比为y:x,B正确;C.由于气体的密度是单位体积内气体的质量,两种气体的体积相同,质量之比为x;y,则密度之比为x:y,正C确;D.由于M(甲):M(乙)=x:y,等质量的甲与乙的分子个数之比应等于二者的物质的量的比,N(甲):N(乙)=[m/ M(甲)]: [m/ M(乙)]= M(乙): M(甲)=y:x;D错误,答案选D。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】[选修 3——物质结构与性质]
X、Y、Z、W、Q、R 均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:

回答下列问题:
(1)Y 元素的基态原子的电子排布式为 ,其第一电离能比 Z 元素原子的第一电离能 (填“高”或“低”)
(2)X 的氯化物的熔点比 Q 的氯化物的熔点 (填“高”或“低”),理由是
(3)光谱证实元素 W 的单质与强碱性溶液反应有 W(OH)4]-生成,则 W(OH)4]-中存在 (填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有 X、R 和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为 ; 晶体中每个镁原子周围距离最近的 R 原子有 个。
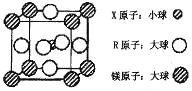
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是:
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含的电子数由多到少是:CO2>SO2>CH4>O2>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是
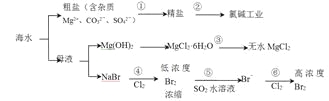
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】军事上的“地表伪装”是使军事保护的外观色彩、红外反射与环境吻合。BASF是在20世纪70年代开发的系新型红外伪装还原染料,该染料为橄榄色或黑色。其化学结构为:

请完成下列问题:
(1)染料BASF的分子式可表示为C2n+24HxN2O6,则x=___________。
(2)1mol该物质与Na反应产生氢气的量及在催化剂作用下加成所需氢气的量,其最大值(物质的量)分别为_____________、____________。
(3)当n=3时,其中碳原子上的一氯取代物可能有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜做阳极
C.在镀件上镀铜时可用金属铜做阳极
D.电解水制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)常用作红色油漆和涂料。下列有关Fe2O3的叙述正确的是
A. 能跟盐酸反应 B. 可溶于水 C. 在空气中易被氧化 D. 有磁性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学用语“NH4Cl”的意义,不正确的是( )
A.氯化铵分子中含有一个NH4+和一个C1-
B.氯化铵由N、H、C1三种元素组成
C.氯化铵晶体由NH4+和C1-构成
D.氯化铵晶体中阴、阳离子个数比为1: 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com