
【题目】[选修 3——物质结构与性质]
X、Y、Z、W、Q、R 均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:

回答下列问题:
(1)Y 元素的基态原子的电子排布式为 ,其第一电离能比 Z 元素原子的第一电离能 (填“高”或“低”)
(2)X 的氯化物的熔点比 Q 的氯化物的熔点 (填“高”或“低”),理由是
(3)光谱证实元素 W 的单质与强碱性溶液反应有 W(OH)4]-生成,则 W(OH)4]-中存在 (填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有 X、R 和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为 ; 晶体中每个镁原子周围距离最近的 R 原子有 个。
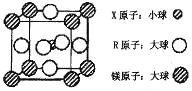
【答案】(1)1s22s22p3,高;
(2)低,X的氯化物为分子晶体,Q的氯化物为离子晶体;
(3)ac;(4)MgNi3C,12。
【解析】
试题分析:X 元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,电子排布式为1s22s22p2,推出X为C,Y 元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 ,推出Y为N,Z元素的族序数是其周期数的三倍,推出Z为O,根据W的原子的电离能,第三电离能到第四电离能发生突变,说明W最外层有3个的电子,因为原子序数增大,即W为Al,Q为前四周期中电负性最小的元素,从左向右电负性增强,即Q为K,元素R位于周期表的第10列,说明R为Ni,(1)根据上述分析,N的基态原子的电子排布式为:1s22s22p3,O的电子排布式是1s22s22p4,根据洪特规则,半满、全满、全空原子处于稳定,因此N的第一电离能比O的第一电离能高;(2)X的氯化物是CCl4,属于分子晶体,Q的氯化物是KCl,属于离子晶体,一般离子晶体熔沸点高于分子晶体;(3)[Al(OH)4]-中H和O以极性共价键形式结合,Al与其中的一个OH-以配位键形式结合,故选项ac正确;(4)根据均摊,X位于晶胞体内,因此晶胞中有1个C,Ni位于六个面上,个数为6×1/2=3,Mg位于顶点,个数为8×1/8=1,因此化学式为MgNi3C,与镁距离最近的Ni原子,位于面上的Ni原子,因此共有12个。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】NO分子曾因污染空气而臭名昭著,但随着“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)在含有Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和NO2-在酸性溶液中转化为NO的离子方程式 。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为_____ 。
(4)将0.05molNO、0.03molO2的混合气体以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为 (设溶液体积变化忽视不计)。
(5)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)判断BaCl2已过量的方法是___________________________。
(2)第④步中,相关的化学方程式是__________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( )
B.天平的砝码已锈蚀( )
C.定容时俯视刻度线( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图示实验装置来分离CO2和CO气体并干燥。图中a为一开关,b为分液漏斗的活塞,通过Y形管和开关分别接c、d两空瘪的球胆,现装置内的空气已排尽。为使实验成功,甲、乙、丙分别盛放的溶液是( )

A.NaHCO3饱和溶液 12 mol/L盐酸 18.4 mol/L H2SO4
B.Na2CO3饱和溶液 2 mol/LH2SO4 NaOH饱和溶液
C.NaOH饱和溶液 2 mol/LH2SO4 18.4 mol/L H2SO4
D.18.4 mol/L H2SO4 NaOH饱和溶液 18.4 mol/L H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/LCH3COONa溶液中,不断通入HCl后,CH3COO-与CH3COOH浓度的变化趋势如下图所示(不考虑溶液体积变化),下列说法不正确的是)

A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随着HCl的通入,c(H+)/c(CH3COO-)值不断减小
D.当n(HCl)=1.0×10-2mol时,溶液中c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、钠合金常用于原子反应堆的导热剂。下列关于金属钠的说法中错误的是
A. 能跟氧气反应 B. 能跟水反应 C. 具有很强的还原性 D. 具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.x∶y等于甲与乙的相对分子质量之比
B.y∶x等于同温同体积下等质量的甲与乙的压强之比
C.x∶y等于同温同压下甲与乙的密度之比
D.x∶y等于等质量的甲与乙的分子个数之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com