
【题目】NO分子曾因污染空气而臭名昭著,但随着“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)在含有Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和NO2-在酸性溶液中转化为NO的离子方程式 。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为_____ 。
(4)将0.05molNO、0.03molO2的混合气体以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为 (设溶液体积变化忽视不计)。
(5)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是____________。
【答案】(1)abc ;(2) NO2-+Cu++2H+=NO↑+Cu2++H2O;
(3)3NO![]() N2O+NO2;(4)0.4mol/L;(5)10g 。
N2O+NO2;(4)0.4mol/L;(5)10g 。
【解析】
试题分析:(1)NO破坏臭氧层、引起酸雨和光化学烟雾、与人体血红蛋白结合,因此人中毒,故选项abc正确;(2)NO2-中N有+3价→+2价化合价降低,Cu+化合价升高,变为Cu2+,根据化合价升降法进行配平,因此反应离子反应方程式为:NO2- + Cu+ + 2H+ = NO↑ + Cu2+ + H2O;(3)红棕色气体为NO2,发生歧化反应,其反应方程式为:)3NO ![]() N2O+NO2;(4)Mg→Mg2+→Mg(OH)2,Fe→Fe3+→Fe(OH)3,沉淀的质量=合金的质量+m(OH-),n(OH-)等于合金失去电子的物质的量,即等于HNO3得到电子的物质的量,沉淀的质量=(4.9+2.24×3×17/22.4)g=10.0g。
N2O+NO2;(4)Mg→Mg2+→Mg(OH)2,Fe→Fe3+→Fe(OH)3,沉淀的质量=合金的质量+m(OH-),n(OH-)等于合金失去电子的物质的量,即等于HNO3得到电子的物质的量,沉淀的质量=(4.9+2.24×3×17/22.4)g=10.0g。


科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
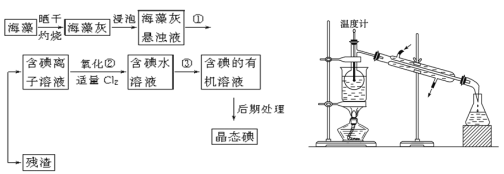
(1)指出提取碘的过程中有关的实验操作名称:①____________,③_____________。
(2)提取碘的过程中,可供选择的有机试剂是____________。
A.苯 B.四氯化碳 C.酒精
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是 。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
① 。
② 。
③ 。
(5)进行上述蒸馏操作时使用水浴的原因是 。
(6)四氯化碳是_________色液体。如果本实验用苯做萃取剂,则上层液体的颜色为 色,下层液体中溶质的主要成分为____________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3 mol二氧化碳气体中,约含有 个二氧化碳分子;2molNH4+中共有 mol电子,与之电子数相等的H2O的质量是 ,这些水若完全电解,产生的氢气在标准状况下的体积为 L。
(2)相同质量的氧气、氢气、二氧化碳中,含有分子数目最少的是 (填化学式,下同),标准状况下体积最大的是 ,原子数最少的是 。
(3)在NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2。如果混合液中共有0.5 mol Cl-,溶液的体积为0.5 L,则混合液中氯化钠的质量为 ;MgCl2的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
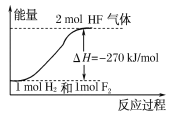
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气体物质体积的大小由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的原子数决定
C.无论外界条件是否相同,不同的气体,若物质的量不同,则它们所含的分子数也不同
D.相同状况下,相同微粒数的Fe、H2O、H2的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250 mL某混合溶液中,HNO3和H2SO4物质的量浓度分别为0.2 mol/L和0.1 mol/L。向该混合溶液中加入1.92 g铜粉,加热充分反应。
(1)写出该反应的离子方程式:___________________。
(2)计算所得溶液中Cu2+的物质的量浓度(写出计算过程,只有结果不得分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
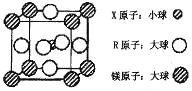
【题目】[选修 3——物质结构与性质]
X、Y、Z、W、Q、R 均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:

回答下列问题:
(1)Y 元素的基态原子的电子排布式为 ,其第一电离能比 Z 元素原子的第一电离能 (填“高”或“低”)
(2)X 的氯化物的熔点比 Q 的氯化物的熔点 (填“高”或“低”),理由是
(3)光谱证实元素 W 的单质与强碱性溶液反应有 W(OH)4]-生成,则 W(OH)4]-中存在 (填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有 X、R 和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为 ; 晶体中每个镁原子周围距离最近的 R 原子有 个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com