
【题目】燃煤取暖是造成我省冬季雾霾天气增多的主要原因之一。请你列出两种煤炭燃烧时产生的大气污染物。________________________
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是
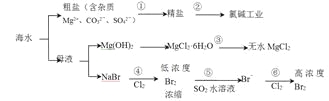
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学用语“NH4Cl”的意义,不正确的是( )
A.氯化铵分子中含有一个NH4+和一个C1-
B.氯化铵由N、H、C1三种元素组成
C.氯化铵晶体由NH4+和C1-构成
D.氯化铵晶体中阴、阳离子个数比为1: 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是 ,铜的基态原子核外电子排布式为 ,元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
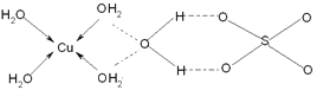
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
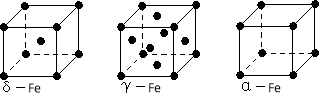
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为 。
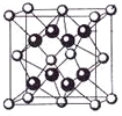
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:① H2 ② 铝 ③ CuO ④ CO2 ⑤ NaHSO4 ⑥ Ba(OH)2固体 ⑦ 氨水 ⑧ 稀硝酸 ⑨ 熔融Al2(SO4)3。
(1)上述状态下可导电的是____________;属于电解质的是____________;属于非电解质的是______________。(填序号)
(2)写出⑤、⑨在水中的电离方程式 、 。
(3)34.2 g ⑨溶于水配成250 mL溶液,SO![]() 的物质的量浓度为___________。
的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=__________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= _____________、CO的平衡转化率= _____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A减少Fe的量 B增加Fe2O3的量 C移出部分CO2
D提高反应温度 E减小容器的容积 F加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份 100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
3 | 加入足量BaCl2溶液,,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
已知加热时NH4++OH-![]() NH3↑+H2O,回答下列问题:
NH3↑+H2O,回答下列问题:
(1)判断混合物中Cl-是否一定存在 _。(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇(C14H12O3)是一种天然的肿瘤化学预防剂,来源于花生、葡萄和桑葚等植物。该物质属于
A. 无机物 B. 有机物 C. 单质 D. 氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com