
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+ CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=__________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= _____________、CO的平衡转化率= _____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A减少Fe的量 B增加Fe2O3的量 C移出部分CO2
D提高反应温度 E减小容器的容积 F加入合适的催化剂
【答案】(1)![]() ,<;(2)0.006mol·L-1·min-1, 60%;(3)C。
,<;(2)0.006mol·L-1·min-1, 60%;(3)C。
【解析】
试题分析:(1)根据化学平衡常数的定义,则K=c(CO2)/c(CO),化学平衡常数只受温度的影响,根据表格数据,随着温度升高,化学平衡常数减小,随着温度升高,化学平衡向逆反应方向移动,根据勒夏特列原理,说明正反应为放热反应,即△H<0;
(2)1000℃时,化学平衡常数为4.0,按照题目中所给物质的量投入,此时的浓度商为1<4,说明反应向正反应方向移动,设反应过程中消耗CO为xmol,则达到平衡时c(CO2)=(1+ x)/10mol·L-1,c(CO)=(1-x)/10mol·L-1,代入化学平衡常数表达式,解的x=0.6mol,v(CO2)=0.6/(10×10)mol/(L·min)=0.006 mol/(L·min),CO的转化率=0.6/1×100%=60%;
(3)Fe、Fe2O3状态是固体,固体的浓度视为常数,因此改变Fe、Fe2O3的量,平衡不移动,故A、B错误;C、移出CO2,降低生成物的浓度,平衡向正反应方向移动,CO转化率增大,故正确;D、此反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,故错误;E、减小容器的容积,增大压强,因为反应前后气体系数之和相等,因此平衡不移动,故错误;F、催化剂对化学平衡无影响,故错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) +2D(g),5min后测得c(D)=0.5mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1mol·L-1·min-1。
xC(g) +2D(g),5min后测得c(D)=0.5mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1mol·L-1·min-1。
①A在5min末的浓度是____________。
②v(B)=____________。
③x=____________。
(2)在25℃时,向100mL含氯化氢14.6g的盐酸溶液中,放入5.6g纯铁粉,反应进行到2min末收集到氢气1.12 L(标准状况),在此后又经过4min,铁粉完全溶解。若不考虑溶液体积的变化,则:
①前2min内用FeCl2表示的平均反应速率是______________。
②后4min内用HCl表示的平均反应速率是________________。
③前2min与后4min相比,反应速率__________较快,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
试验序号 | 实验步骤 | 实验现象 | 结论 |
① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
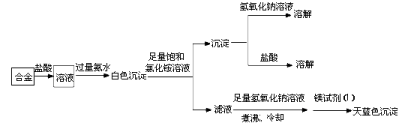
由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
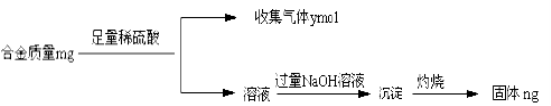
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n
B.m、y
C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
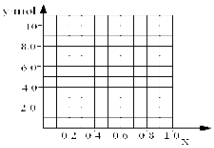
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
② CO(g)+2H2(g) ![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20mol CH4(g)和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
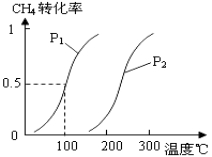
(1)温度不变,缩小体积,增大压强,①的反应速率 ______(填“增大”、“减小”或“不变”),平衡向 ___方向移动。
(2)温度升高,反应①的ΔH1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 ______。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3 a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有_________(填离子符号),由此可以证明该氧化还原反应为_________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________;一段时间后,溶液中有大量气泡出现,随后有红褐色沉淀生成。产生气泡的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.叠氮酸(HN3)与醋酸酸性相近,0.1 mol·L-1NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH![]() )=c(Cl-)
)=c(Cl-)
D.0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:
2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
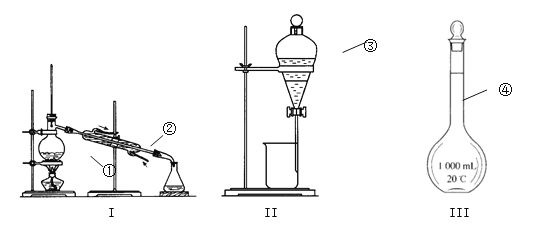
① ;② ;③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)若用四氯化碳萃取碘水中的碘,振荡静置如图Ⅱ,可观察到液体分层,上层为 层(填“H2O”或“CCl4”);下层呈 色。分液后再用装置Ⅰ进行分离的方法称作 ,在加热前,①中要加入少量碎瓷片,目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·l0H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
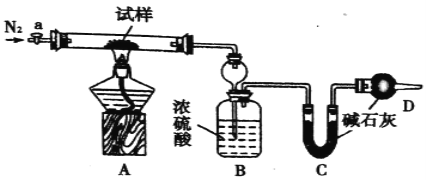
实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ.关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:________________;_______________。
(2)装置B的作用为_______________。装置C的作用为_______________。
(3)实验过程中通入N2的目的为__________。
(4)实验结束后发现装置A中硬质玻璃管右端有水珠,则w(NaHCO3)的计算式为:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com