
����Ŀ���ɼ������ӻ�������ɵĻ����������������е������֣�K����Cl����NH4+��Mg2����CO32����Ba2����SO42�������û��������ˮ��ó�����Һ����ȡ3�� 100 mL����Һ�ֱ��������ʵ�飺
ʵ����� | ʵ������ | ʵ���� |
1 | ����AgNO3��Һ | �а�ɫ�������� |
2 | ��������NaOH��Һ������ | �ռ�������0.896L������ɱ�״���� |
3 | ��������BaCl2��Һ,�������ó���ϴ�ӡ�������أ���������м�������ϡ���ᣬϴ�ӡ�������� | ��һ�γ��ض���Ϊ6.27g���ڶ��γ��ض���Ϊ2.33g |
��֪����ʱNH4++OH��![]() NH3��+H2O,�ش��������⣺
NH3��+H2O,�ش��������⣺
��1���жϻ������Cl���Ƿ�һ������ _������ǡ�����
��2��д����Һ��һ�����ڵ����Ӽ������ʵ���Ũ�ȣ� ��
���𰸡���1���� ��2��c��SO42����=0.1mol/L
c��CO32����=0.2mol/L c��NH4+��=0.4mol/L c��K+����0.2mol/L
��������
�����������ij��Һ�к������������е������֣�K����Cl����NH4+��Mg2����CO32����Ba2����SO42����ȡ100mL��Һ�������м���AgNO3��Һ����Ӧ������ɫ�����������Dz���AgCl��ɫ������Ҳ�����Dz���Ag2SO4��������˲���ȷ���Ƿ�Cl-����100mL��Һ�м�������NaOH��Һ�����ȣ��ռ�������0.896L������ɱ�״������֤������NH4+�����ݵ�Ԫ���غ�ɵ�n��NH4+��=n��NH3��=0.869L��22.4L/mol=0.04mol����100mL��Һ�м�������BaCl2��Һ,�������ó���ϴ�ӡ�������أ���������м�������ϡ���ᣬϴ�ӡ�������أ���һ�γ��ض���Ϊ6.27g���ڶ��γ��ض���Ϊ2.33g��˵����Һ�к�CO32����SO42����n��SO42���� =2.33g��233g/mol=0.01mol��n��CO32����=��6.27g-2.33g�� ��197g/mol=0.02mol������CO32����SO42����Ba2����Mg2�����γ�BaCO3��MgCO3��BaSO4���������ܴ������棬���һ������Ba2����Mg2������֪�����ӵ�����ɣ�NH4+��0.04mol������������ǣ�0.02mol��2+0.01��2=0.06mol�����������Ӵ��е������������������Һ�ʵ����Կ�֪��Һ�л�Ӧ�ú���������K���������ʵ�����0.06mol- 0.0=mol =0.02mol��
��1������ʵ��1��Cl���Ƿ���ڵ��ж��Dz���ȷ����
��2������ʵ��1��3�жϻ������һ�����ڵ�������NH4+��CO32����SO42������Ũ�ȷֱ���c��NH4+��=0.04mol��0.1L��0.4mol/L��c��CO32����=0.02mol��0.1L��0.2mol/L��c��SO42����=0.01mol��0.1L��0.1mol/L�����������Ӳ���ȷ������K�������ʵ�����0.02mol��������Ũ��c��K+����0.02mol��0.1L��0.2mol/L��


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ijAl2��SO4��3��ҺV mL�к���Al3��a g��ȡ��V/4 mL��Һϡ�ͳ�V mL��SO42�D ���ӵ����ʵ���Ũ��Ϊ ���ú�a��V�Ĵ���ʽ��ʾ�����������������
��2����״���£��ܶ�Ϊ0.75 g/L��C2H4��CH4��ɵĻ�������У�C2H4���������ԼΪ ����������λ��Ч������
��3����״���£���V L A������Ħ������ΪM g/mol������0.3 Lˮ�У�������Һ�ܶ�Ϊ�� g/mL�������Һ���ʵ���Ũ��Ϊ �����ú�����V ��M�Ĵ���ʽ��ʾ�����������������
��4��һ���¶��£���a molSO3����ͨ�����ΪV L���ܱ������з������·�Ӧ��2SO3=2SO2+O2��һ��ʱ��֮�����������������ʵ���Ϊb mol��2b<a���������ʱ���ڣ���Ӧǰ�������ѹǿ��Ϊ ����Ӧǰ��������ܶȱ�Ϊ ����Ӧ�������ƽ����Է�������Ϊ �������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼúȡů�������ʡ�������������������Ҫԭ��֮һ�������г�����ú̿ȼ��ʱ�����Ĵ�����Ⱦ�________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����˵������ȷ���ǣ� ��
A��0.2 mol��L��1��NaHCO3��Һ�У�c(Na��)��c(HCO![]() )��c(OH��)��c(H��)
)��c(OH��)��c(H��)
B��������(HN3)���������������0.1 mol��L-1NaN3ˮ��Һ������Ũ�ȴ�С˳��Ϊ��
c(Na��)��c(N![]() )��c(OH��)��c(H��)
)��c(OH��)��c(H��)
C����ˮ����ε�����������Һ��pH��7������Һ��c(NH![]() )��c(Cl��)
)��c(Cl��)
D��0.02mol/L��NaOH��Һ��0.04mol/L��NaHC2O4��Һ��������Һ��
2c(OH��)+c(C2O42-)=c(HC2O4-)+2c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������д����л�ѧ�����б�������ȷ����( )
A���Ͻ������ϵ������ֹ�ؽ�����Ⱦ������ˮԴ
B��Ƥ��մ����֬ʱ����������������ϡ��Һ��ϴ
C�������Ƶ�ˮ��Һ�׳�ˮ���������Ʊ��轺��ľ�ķ������ԭ��
D���ú���ɫ�����ظ���ص���������Ƽ����������Ҵ��Ļӷ��Ժͻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
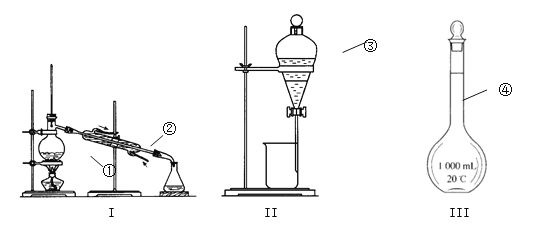
�� ���� ���� ���� ��
��2�������������У�ʹ��ʱ�������Ƿ�©ˮ���� ������������ţ�
��3���������Ȼ�̼��ȡ��ˮ�еĵ⣬������ͼ�����ɹ۲쵽Һ��ֲ㣬�ϲ�Ϊ �㣨����H2O������CCl4�������²�� ɫ����Һ������װ�������з���ķ������� ���ڼ���ǰ������Ҫ�����������Ƭ��Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ײ�������ֱָ���ڼ�������ʮ���IJ��ϡ��罫�����ײ�������ɢ��Һ���ɢ���У����û������е�������
A����ȫ������Ĥ B���ж����ЧӦ
C��������Һһ���ܵ��� D����������һ��Ϊ����Һ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1��������ҪNaOH�������� g��
��2�����������������ձ� ��ҩ�� ��250mL����ƿ ��500mL����ƿ ����������������ƽ ����Ͳ����������������Һ����ʹ�õIJ������� ������ţ�����ȱ�ٵ������� ��
��3�����ݵľ�����������ǣ� ��
��4�����ݼ����֪��������Ͳ��ȡ��������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������Ϊ mL�����ʵ������15mL��20mL��50mL��Ͳ��Ӧѡ�� mL��Ͳ��á�
��5�����ƹ����У����в�����������ƫ�ߵ��� ������ţ�
��δϴ���ձ��������� ������NaOH��ʱ��̫��
������ʱ���ӿ̶� ������ƿ�����������������ˮ
��NaOH��Һδ��ȴ�����¾�ת�Ƶ�����ƿ ����ȡŨ����ʱ��������Ͳ�̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪N2(g) +3H2(g)![]() 2NH3(g) ��H=��92.3kJ��mol��1����һ���¶Ⱥʹ����������£���һ�ܱ������У�ͨ��1molN2��3molH2���ﵽƽ��״̬I����ͬ�����£�����һ�����ͬ���ܱ�������ͨ��0.9molN2��2.7molH2��0.2molNH3���ﵽƽ��״̬II��������˵����ȷ����________
2NH3(g) ��H=��92.3kJ��mol��1����һ���¶Ⱥʹ����������£���һ�ܱ������У�ͨ��1molN2��3molH2���ﵽƽ��״̬I����ͬ�����£�����һ�����ͬ���ܱ�������ͨ��0.9molN2��2.7molH2��0.2molNH3���ﵽƽ��״̬II��������˵����ȷ����________
A������ƽ��״̬��ƽ�ⳣ���Ĺ�ϵ��KI <KII
B��H2�İٷֺ�����ͬ
C��N2��ת���ʣ�ƽ��I <ƽ��II
D����Ӧ�ų���������QI=QII< 92.3 kJ
��2������ͬ�����£�������������ͬ���ܱ������г���һ������N2��H2��NH3��Ҫ��Ӧ���淴Ӧ��ʼ�ﵽƽ�⣬��ƽ��ʱ���������������Ϊ50%�������İ��������ʵ����ķ�Χ��__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com