
【题目】(1)某Al2(SO4)3溶液V mL中含有Al3+a g,取出V/4 mL溶液稀释成V mL后,SO42― 离子的物质的量浓度为 (用含a、V的代数式表示,化简到最简整数比)
(2)标准状况下,密度为0.75 g/L的C2H4与CH4组成的混合气体中,C2H4的体积分数约为 。(保留三位有效数字)
(3)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.3 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为 。(用含ρ、V 、M的代数式表示,化简到最简整数比)
(4)一定温度下,将a molSO3气体通入体积为V L的密闭容器中发生如下反应:2SO3=2SO2+O2,一段时间之后测得生成氧气的物质的量为b mol(2b<a),则这段时间内,反应前后气体的压强比为 ,反应前后气体的密度比为 ,反应后气体的平均相对分子质量为 。(化简到最简整数比)
【答案】
(1)![]() mol/L;
mol/L;
(2)6.67%或0.0667;
(3)1000ρV /(VM +6720 )mol/L;
(4)a/(a+b);1:1;80a/(a+b);
【解析】
试题分析:(1)agAl3+的物质的量=![]() =
=![]() mol,溶液中n(Al3+):n(SO42-)=2:3,VL溶液中n(SO42-)=
mol,溶液中n(Al3+):n(SO42-)=2:3,VL溶液中n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,故
mol,故![]() mL溶液中n(SO42-)=
mL溶液中n(SO42-)=![]() mol×
mol×![]() =
=![]() mol,故稀释后溶液中SO42-物质的量浓度为
mol,故稀释后溶液中SO42-物质的量浓度为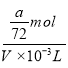 =
=![]() mol/L=
mol/L=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
(2)标准状况下,密度为0.75 g/L的C2H4与CH4组成的混合气体的平均摩尔质量为中0.75 g/L×22.4L=16.8g/mol,根据十字交叉法,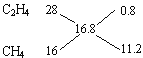 ,C2H4和CH4的物质的量之比为
,C2H4和CH4的物质的量之比为![]() =
=![]() ,因此C2H4的体积分数=
,因此C2H4的体积分数=![]() ×100%=6.67%,故答案为:6.67%;
×100%=6.67%,故答案为:6.67%;
(3)标况下,VL气体的物质的量=![]() =
=![]() mol,气体的质量为
mol,气体的质量为![]() mol×Mg/mol=
mol×Mg/mol=![]() g,水的质量为300mL×1g/mL=300g,溶液的质量为(300+
g,水的质量为300mL×1g/mL=300g,溶液的质量为(300+![]() )g,溶液的体积为(300+
)g,溶液的体积为(300+![]() )g÷1000ρ g/L=
)g÷1000ρ g/L=![]() L,故该溶液的物质的量浓度为
L,故该溶液的物质的量浓度为![]() mol÷
mol÷![]() L=
L=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
(4)根据2SO3=2SO2+O2,可知生成氧气的物质的量为b mol,同时生成2b mol SO2,反应2b mol SO3,同温同体积条件下,气体的压强之比等于物质的量之比,反应前后气体的压强比为![]() =
=![]() ;气体的质量不变,容器的体积不变,气体的密度不变,反应前后气体的密度比为1:1;反应后气体的平均相摩尔质量为
;气体的质量不变,容器的体积不变,气体的密度不变,反应前后气体的密度比为1:1;反应后气体的平均相摩尔质量为![]() =
=![]() g/mol,反应后气体的平均相摩尔质量为
g/mol,反应后气体的平均相摩尔质量为![]() ,故答案为:
,故答案为:![]() ;1:1;
;1:1;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度改变为1.5 mol·L-1
B. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
C. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是
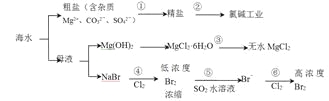
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜做阳极
C.在镀件上镀铜时可用金属铜做阳极
D.电解水制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)常用作红色油漆和涂料。下列有关Fe2O3的叙述正确的是
A. 能跟盐酸反应 B. 可溶于水 C. 在空气中易被氧化 D. 有磁性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中的用量很大。其中普通锌锰电池的构造图如右图所示。回答下列问题:
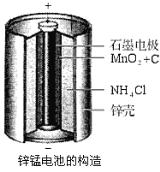
(1)电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,正极发生的主要反应是________________________。
(2)下图表示从废旧普通锌锰电池除去锌壳和电极后的内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
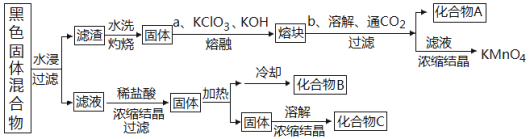
①黑色固体混合物水浸时为提高浸出速率,常采用的措施为________________(答两条);得到滤液加入稀盐酸的作用为__________________。
②滤渣水洗灼烧后固体主要成份只有一种,操作a中得到熔块的主要成分是K2MnO4,该过程中发生反应的化学方程式为:_____________________________。
③图中产物的化学式分别为:A__________、B_________。
(3)准确称量得到的KMnO4(不含能与草酸反应的杂质)3.160 g,放入小烧杯中,加水溶解后转移到200mL容量瓶中定容,在锥形瓶中用差量法称取0.6700 g无水草酸钠,加入足量硫酸溶液溶解,加热至75~80℃。用已配制好的KMnO4溶液进行滴定,消耗溶液体积为22.50mL。
已知Mr(Na2C2O4)=134 Mr(KMnO4)=158
①判断滴定终点的现象是__________________。
②KMnO4的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学用语“NH4Cl”的意义,不正确的是( )
A.氯化铵分子中含有一个NH4+和一个C1-
B.氯化铵由N、H、C1三种元素组成
C.氯化铵晶体由NH4+和C1-构成
D.氯化铵晶体中阴、阳离子个数比为1: 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是 ,铜的基态原子核外电子排布式为 ,元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
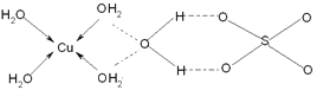
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
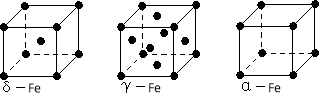
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为 。
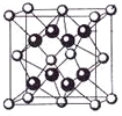
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份 100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
3 | 加入足量BaCl2溶液,,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
已知加热时NH4++OH-![]() NH3↑+H2O,回答下列问题:
NH3↑+H2O,回答下列问题:
(1)判断混合物中Cl-是否一定存在 _。(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com