
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、1.0L1.0mo1?L-1的NaAlO2水溶液中含有的氧原子数为2N0 |
| B、12g石墨烯(单层石墨)中含有六元环的个数为0.5N0 |
| C、25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 |
| D、1mol的羟基与1 mol的氢氧根离子所含电子数均为9 N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能全部透过半透膜 |
| B、用激光笔照射有光亮的“通路” |
| C、所得溶液一定能导电 |
| D、所得物质一定为悬浊液或乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
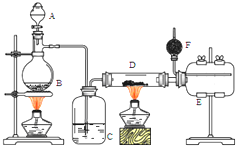 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、C2H4O2 |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O2 |
| D、C2H4、C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
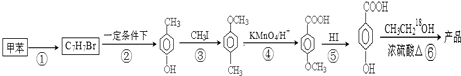
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 的同分异构体很多,其中符合下列条件有
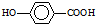
的同分异构体很多,其中符合下列条件有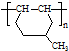 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
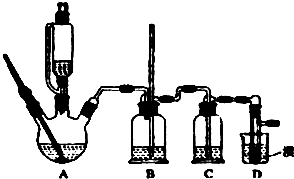 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH| H2SO4(浓) |
| 170℃ |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com