
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
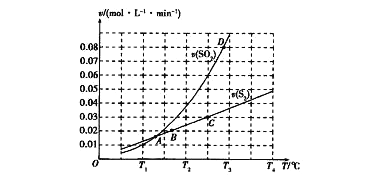
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
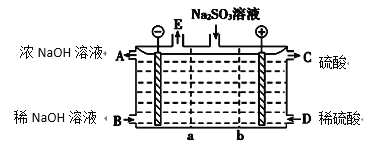
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
【答案】CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g) H=+352 kJ/mol C < A 阳 H2 SO32--2e-+H2O=2H++SO42-
【解析】
(1)依据图像和盖斯定律进行推算;
(2)①达到平衡状态时,速率之比等于计量数之比,且速率方向相反,依据正逆反应速率相等判断;
②从图像可以看出,温度升高,SO2的生成速率较快,反应向逆向移动,故该反应为放热反应,H![]() ;
;
③对于2C(s)+2SO2(g) ![]() S2(g)+2CO2(g) H
S2(g)+2CO2(g) H![]() ;的可逆反应,依据勒夏特列原理进行分析既得答案;
;的可逆反应,依据勒夏特列原理进行分析既得答案;
(3)由C为硫酸,可知阳极反应式为SO32--2e-+H2O===SO42-+2H+,A为浓NaOH,阴极反应式为2H2O+2e-===H2↑+2OH-,依据电解池原理分析即可;
(1)由图像可知①CH4(g)![]() 2O2(g)=CO2(g)
2O2(g)=CO2(g)![]() 2H2O(g)
2H2O(g) ![]() H=-802KJ/mol, ②S(s)
H=-802KJ/mol, ②S(s)![]() 2O2(g)=SO2(g)
2O2(g)=SO2(g) ![]() H=-577KJ/mol,依据盖斯定律①-2
H=-577KJ/mol,依据盖斯定律①-2![]() ②可以得到:CH4(g)
②可以得到:CH4(g)![]() 2SO2(g)= CO2(g)
2SO2(g)= CO2(g)![]() 2 S(s)
2 S(s)![]() 2 H2O(g)
2 H2O(g) ![]() H=+352KJ/mol,;
H=+352KJ/mol,;
本题答案为:CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g) H=+352 kJ/mol;
(2)①达到平衡状态时,SO2(g)和S2(g)速率之比等于计量数之比,且速率方向相反,A点时,SO2(g)的生成速率和S2(g)的生成速率相等,不符合计量数关系,没有达到平衡状态;B点时,SO2(g)的生成速率和S2(g)的生成速率不相等,但不符合计量数比关系,没有达到平衡状态;C点时,SO2(g)的生成速率和S2(g)的生成速率不相等,但符合计量数比关系,达到平衡状态;D点时,SO2(g)的生成速率和S2(g)的生成速率不相等,但不符合计量数比关系,没有达到平衡状态;
②从图像可以看出,温度升高,SO2的生成速率较快,反应向逆向移动,故该反应为放热反应,H![]() ;
;
对于2C(s)+2SO2(g) ![]() S2(g)+2CO2(g) H
S2(g)+2CO2(g) H![]() ;的可逆反应,
;的可逆反应,
A.降低温度,平衡向正向移动,SO2平衡转化率增大,故A正确;
B.C是固体,改变其用量,平衡不移动,SO2平衡转化率不变,故B错误;
C. 减小容器体积,平衡向逆向移动,SO2平衡转化率减小,故C错误;
D. 添加高效催化剂,只能加快反应速率,平衡不移动,SO2平衡转化率不变,故D错误;
本题答案为:C,![]() ,A;
,A;
(3)由C为硫酸,可知阳极反应式为SO2--2e-+H2O===SO42-+2H+,故b为阴离子交换膜,A为浓NaOH,阴极反应式为2H2O+2e-===H2↑+2OH-,Na+要移至阴极区,故a为阳离子交换膜。E是H2;
本题答案为:阳,H2,SO32--2e-+H2O===SO42-+2H+。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学与自然资源的开发利用说法中不正确的是( )
A. 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴
B. 石油裂化的主要目的是提高汽油的产量
C. 煤干馏的产品很多,是一个化学変化
D. 海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
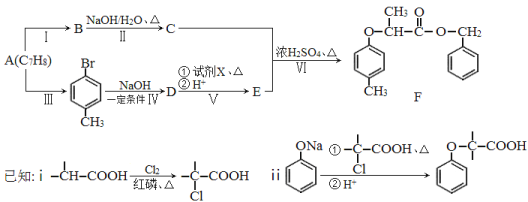
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取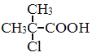 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析不正确的是
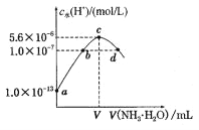
A. 硫酸的浓度为0.05mol/L
B. V=20
C. c点所示的溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. d点所示溶液中:c(NH4+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
A. 固体A的质量B. 混合气体的密度
C. 混合气体的平均相对分子质量D. 混合气体的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一事实能说明生物界与非生物界具有统一性
A. 生物与非生物都具有化学变化
B. 生物与非生物都由元素构成
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 生物与非生物都含有碳元素
查看答案和解析>>
科目:高中化学 来源: 题型:
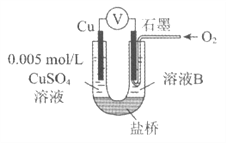
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是( )
A.K+、Br-、CO32-B.Al3+、H+、MnO4-
C.NH4+、Fe3+、SO42-D.Ag+、Cu2+、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com