
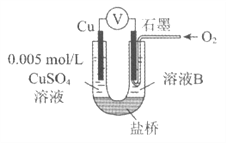
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
【答案】 Fe—2e-=Fe2+ 在金属活动性顺序中,Cu在H后,Cu不能置换出H2 O2+4H++4e-=2H2O O2浓度越大,其氧化性越强,使电压值增大 溶液的酸碱性 排除溶液中的Na+(或SO42-)对实验的可能干扰 排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响 溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性)
【解析】分析:(1).①.I中的铁主要发生析氢腐蚀,铁在负极失电子发生氧化反应;②.铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,则在正极上氧气得电子发生还原反应生成水;(2). ①.实验Ⅱ、Ⅲ、IV的电解质相同,不同的是氧气的浓度,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高;②.实验Ⅳ、V是利用电解质溶液的酸碱性不同,来判断电压表的指针偏转情况;③.实验IV中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰;④.为达到丁同学的目的,经讨论,同学们认为应改用如图装置对IV、V重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c'、d',且c'>d',说明溶液酸性越强,O2的氧化性越强。
详解:(1). ①. I中的铁主要发生析氢腐蚀,则铁在负极失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
②. 在金属活动性顺序中,Cu在H的后面,铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,则在正极上氧气得电子发生还原反应生成水,其正极的电极反应式是O2+4H++4e-=2H2O,故答案为:在金属活动性顺序中,Cu在H后,Cu不能置换出H2;O2+4H++4e-=2H2O;
(2). ①. 实验Ⅱ、Ⅲ、IV的电解质相同,不同的是氧气的浓度,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高,所以O2浓度越大,其氧化性越强,使电压值增大,故答案为:O2浓度越大,其氧化性越强,使电压值增大;
②. 在实验Ⅳ、V中是利用溶液的酸碱性不同来判断电压表的指针偏转情况,所以Ⅳ、V进行比较,其目的是探究溶液的酸碱性对O2氧化性的影响,故答案为:溶液的酸碱性;
③. 实验IV中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰,故答案为:排除溶液中的Na+(或SO42-)对实验的可能干扰;
④. 为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、V重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是溶液酸性越强,O2的氧化性越强,故答案为:排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性)。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列关于ΔH的说法正确的是 ( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时反应放热,ΔH<0时反应吸热
C.ΔH越大,说明反应放出的热量越多
D.一个化学反应中,当反应物能量大于生成物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
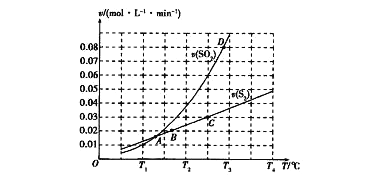
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
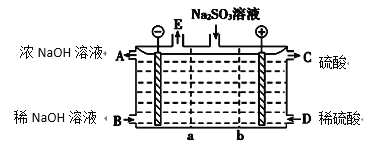
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素,它们的原子序数依次增大。其中A与C、B与E分别是同主族元素。已知B、E两元素间可形成EB2和EB3两种化合物,两者相对分子质量相差16。又知A、C两元素原子序数之和是B、E两元素原子序数之和的![]() , D的单质是一种常见的半导体材料。请回答下列问题:
, D的单质是一种常见的半导体材料。请回答下列问题:
(1)D位于元素周期表的位置是___________________。
(2)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________,该化合物中所含化学键的类型有_________________。
(3)A2B与A2E的沸点:A2B______A2E(填“高于”或“低于”),其原因是:___________________________。
(4)由A、B、C、E四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体。写出X与盐酸反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(B)=0.3 mol·L-1· s-1B. v(A)=0.5mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=30 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是
A. 反应开始到平衡过程中气体的平均相对分子质量不变
B. 若要提高SO2的转化率,可鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有下列十组物质:
①O2和O3 ②126C和146C ③4039K和4020Ca ④甲烷和丙烷 ⑤甲醇和乙二醇
⑥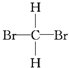 和
和 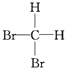 ⑦
⑦ 和
和
⑧葡萄糖和果糖 ⑨蔗糖和麦芽糖 ⑩淀粉和纤维素
(1)互为同分异构体的是_______________;(填序号)
(2)互为同系物的是_______________;(填序号)
(3)⑦中有机物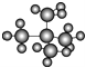 按系统命名法命名为______________。
按系统命名法命名为______________。
Ⅱ.写出下列化合物的名称或结构简式:
① 有机物![]() 的系统名称是________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________________。
的系统名称是________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________________。
② ![]() _________________________,
_________________________,
③ CH2===CHCOOH_____________________________,
④ 2,5 -二甲基-2,4 -己二烯的结构简式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体的健康,除了必须的大量元素外,还需要微量元素,下列各组元素全为微量元素的是 ( )
A. Fe、Zn、Cu、Mg B. Fe、Ca、Cu、Mo
C. Cl、Mg、B、P D. B、Mo、Fe、Zn
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com