
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ������������������A��C��B��E�ֱ���ͬ����Ԫ�ء���֪B��E��Ԫ�ؼ���γ�EB2��EB3���ֻ����������Է����������16����֪A��C��Ԫ��ԭ������֮����B��E��Ԫ��ԭ������֮�͵�![]() �� D�ĵ�����һ�ֳ����İ뵼����ϡ���ش��������⣺
�� D�ĵ�����һ�ֳ����İ뵼����ϡ���ش��������⣺
(1)Dλ��Ԫ�����ڱ���λ����___________________��
(2)д����B��C����Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽ��________���û�������������ѧ����������_________________��
(3)A2B��A2E�ķе㣺A2B______A2E(��������������������)����ԭ���ǣ�___________________________��
(4)��A��B��C��E����Ԫ���γɵ�����X�������ᷴӦ�ܹ����ɾ��д̼�����ζ�����塣д��X�����ᷴӦ�����ӷ���ʽ��___________________________��
���𰸡��������ڵ�IVA�� ![]() ���Ӽ������ۼ� ���� H2O����֮�����γ������ʹˮ�ķе��H2S�ĸ� HSO3-+H+ =SO2��+H2O
���Ӽ������ۼ� ���� H2O����֮�����γ������ʹˮ�ķе��H2S�ĸ� HSO3-+H+ =SO2��+H2O
��������
��B��E��ͬһ�����Ԫ�أ�B��E��Ԫ�ؼ���γ�EB2��EB3���ֻ����������Է����������16����֪BΪOԪ�أ�EΪSԪ�أ�B��E�γɵĻ�����ΪSO2��SO3��S��OԪ��ԭ������֮��Ϊ24����A��CԪ��ԭ������֮��Ϊ12����A��Cͬ���壬����AΪHԪ�أ�CΪNaԪ�أ�Dԭ������С��S��D�ĵ�����һ�ֳ����İ뵼����ϣ���D��SiԪ�أ�����Ԫ�ض�Ӧ�ĵ��ʡ�����������ʽ��Ԫ�������ɽ����⡣
���������ƶϿ�֪��AΪHԪ�أ�BΪOԪ�أ�CΪNaԪ�أ�D��SiԪ�أ�EΪSԪ�ء�
(1)D��SiԪ�أ���������Ų���2��8��4�����Dλ��Ԫ�����ڱ���λ���ǵ������ڵ�IVA�壻
(2)��B��C����Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����Na2O2�����ӻ����2��Na+��O22-ͨ�����Ӽ���ϣ�Na2O2�ĵ���ʽΪ��![]() ���û������к������Ӽ����Ǽ��Թ��ۼ���
���û������к������Ӽ����Ǽ��Թ��ۼ���
(3)H2O��H2S�����⻯�����嶼���ڷ��Ӿ��壬���Ӿ��������ʵķе�������Է������������ȣ���ˮ�к�������������в�����������Զ��ߵķе�ϸ�����H2O��
(4)A��B��C��E����Ԫ���γɵ�����XΪNaHSO3��NaHSO3�����ᷴӦ���ɵĶ���������д̼�����ζ���÷�Ӧ�����ӷ���ʽΪ��HSO3-+H+=SO2��+H2O��


 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��H1=-akJ��mol-1
��4NH3(g)+3O2(g)=2N2(g)+6H2O(g)��H2=-bkJ��mol-1
��H2(g)+1/2O2(g)=H2O(g)��H3=-ckJ��mol-1
��H2(g)+1/2O2(g)=H2O(l)��H4=-dkJ��mol-1
����������ȷ���ǣ� ��
A. �������Ȼ�ѧ����ʽ��֪��H3����H4
B. H2��ȼ����ΪdkJ��mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)��H=(-a-b)kJ��mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)��H=(6d-b)kJ��mol-1
2N2(g)+6H2(g)��H=(6d-b)kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mLijŨ�ȵ�������Һ�е���0.1mol/L��ˮ����Һ��ˮ�����������Ũ������백ˮ������仯��ͼ�����з�������ȷ����
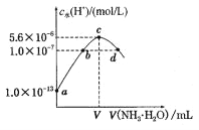
A. �����Ũ��Ϊ0.05mol/L
B. V=20
C. c����ʾ����Һ�У�c(NH4+)��c(SO42-)��c(H+����c��OH-��
D. d����ʾ��Һ�У�c(NH4+)=c(SO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ����ܱ������У�������Ӧ��A(s)+2B(g)![]() C(g)+D(g)�����������������ٱ仯ʱ������������Ӧ�Ѵ�ƽ�����
C(g)+D(g)�����������������ٱ仯ʱ������������Ӧ�Ѵ�ƽ�����
A. ����A������B. ���������ܶ�
C. ��������ƽ����Է�������D. ��������ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ʵ��˵������������������ͳһ��
A. ����������ﶼ���л�ѧ�仯
B. ����������ﶼ��Ԫ�ع���
C. ���������Ļ�ѧԪ��������Ȼ���ж������ҵ�
D. ����������ﶼ����̼Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ܿ�[��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��]��ȡCoCl2��6H2O�Ĺ����������£�
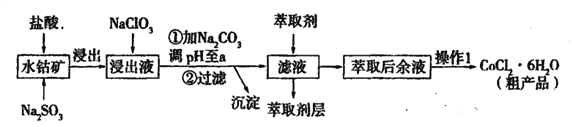
��֪���ٽ���Һ���е���������Ҫ�У�H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1���ٽ��������м���Na2SO3��Ŀ����____��
�������Һ�м���NaClO3�����ӷ�Ӧ����ʽΪ____��
��Ϊ��߽�ȡ�ʳ����ʵ�����NaClO3Ũ�ȣ������¶Ȼ��ɲ�ȡ��ʩ____����һ�����ɣ�����������������Һ���м���NaClO3����ʱ�����ܻ������ж����壬д�����ɸ��ж���������ӷ���ʽ____��
��2��������Na2CO3��pH��a�����������õ��ij����ɷ�Ϊ____��
����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ����ȡ����������____����ʹ�õ�����pH��Χ��____�����ţ���
A.2.0��2.5 B. 3.0��3.5 C.4.0��4.5 D.5.0��5.5

��������1���а����Ļ���ʵ�����������������_______��____���ˡ���ѹ��ɡ�
��3��Ϊ�ⶨ�ֲ�Ʒ��CoCl2��6H2O��������ȡһ�������Ĵֲ�Ʒ����ˮ����������AgNO3��Һ�����ˣ�ϴ�ӣ���������ɺ����������ͨ�����㷢�ֲִ�Ʒ��CoCl2��6H2O��������������100%����ԭ�������____����һ�����ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
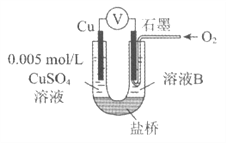
����Ŀ��ijС��ͬѧ����ԭ���װ��̽�����ʵ����ʡ�
������ʾ��ԭ���װ���У�������Ӧ��Ļ�ԭ��Խǿ����������Ӧ���������Խǿ��ԭ��صĵ�ѹԽ��
��1��ͬѧ�������±���װ�ý���ʵ�鲢��¼��
װ�� | ��� | �缫A | ��ҺB | ���������� |
| I | Fe | pH��2�� H2SO4 | ����װ�ú�ʯī���������ɫ���ݣ���ѹ��ָ��ƫת |
�� | Cu | pH��2�� H2SO4 | ����װ�ú�ʯī��������������ѹ��ָ��ƫת����¼����Ϊa |
��ͬѧ����Ϊʵ��I������Ҫ���������ⸯʴ���为����Ӧʽ��__________��
�����ʵ�������ͬѧ��Ϊ�����ܷ������ⸯʴ���������ж�������__________��
��ͬѧ��Ϊʵ�����Ӧ����������ʴ���������ĵ缫��Ӧʽ��__________��
��2��ͬѧ����������װ�ò���Cu��ʯīΪ�缫����ʵ�飬̽��ʵ���ָ��ƫתԭ��Ӱ��O2�����Ե����ء�
��� | ��ҺB | ���������� |
�� | ����е�pH��2�� H2SO4 | ��Һ������ú���ǣ�����װ�ú�ѹ��ָ��ƫת����¼����Ϊb |
�� | pH��2��H2SO4 | ��ʯīһ���ͨ��O2������װ�ã���ѹ��ָ��ƫת����¼����Ϊc��ȡ���缫������Һ�м�������ŨNa2SO4��Һ��Ϻ���缫������O2ͨ�룬��ѹ��������Ϊc |
V | pH��12��NaOH | ��ʯīһ���ͨ��O2������װ�ã���ѹ��ָ��ƫת����¼����Ϊd |
�ٱ�ͬѧ�Ƚ�ʵ��II�����ĵ�ѹ������Ϊ��c>a>b�������ԭ����__________��
�ڶ�ͬѧ�Ԣ���V���бȽϣ���Ŀ����̽��__________��O2�����Ե�Ӱ�졣
��ʵ����м���Na2SO4��Һ��Ŀ����__________��
��Ϊ�ﵽ��ͬѧ��Ŀ�ģ������ۣ�ͬѧ����ΪӦ������ͼװ�öԢ���V�ظ�����ʵ�飬�������ͼ��_________���ظ�ʵ��ʱ����¼��ѹ����������Ϊc'��d'����c'>d'���ɴ˵ó��Ľ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����������صķŵ�ԭ��ͼ(��Ĥֻ���������ͨ��)����طŵ�ʱ�ķ�Ӧ�ɱ�ʾΪ��4Li+O2+2H2O=4LiOH���������������طŵ�ʱ���й�˵����ȷ���ǣ� ��
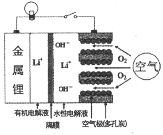
A. ������Ӧʽ��Li-e��=Li+
B. ÿת��2mol���ӣ�����11.2L��O2
C. Li+�������ص������ƶ�
D. ����ȥ����Ĥ���л����Һ���ý������ˮ�Ե��Һֱ�ӽӴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʶ�Ӧ�Ļ�ѧʽ�������
A.ƫ���ᱵ Ba(AlO2)2B.���� KAl(SO4)2��12H2O
C.����� (CH3COO)2CaD.��������� CaHSO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com