
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
科目:高中化学 来源: 题型:
【题目】氢气用于工业合成氨 N2(g)+3H2(g)2NH3(g);△H=﹣92.2kJmol﹣1 . 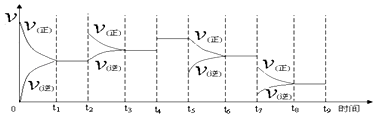
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是
t4 .
t5 .
t7 .
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,此时放出热量46.1kJ.则n= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.固体氯化钠不导电,所以氯化钠是非电解质
B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.SO3溶于水能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: 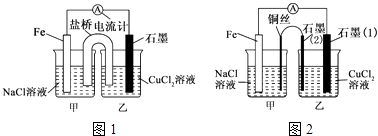
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .
(4)在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由富锰渣(含2MnO·SiO2、3MnO·Al2O3·3SiO2、FeO及重金属盐等)制备高纯MnCl2的工艺流程如下:

回答下列问题:
(1)“浸取”时的温度与四种元素的浸取率如图所示。

①工艺上控制75℃的主要原因是____________________________________________。
②铁和铝的浸出率从72℃明显下降的可能原因是___________________________________。
(2)“氧化”时发生反应的离子方程式为___________________________________________。
(3)通过调整pH可以“除铁和铝”。常温下,三种氢氧化物开始沉淀和沉淀完全(使其浓度小于1×10-6mol/L)的部分数据如下表:
Mn(OH)2 | Fe (OH)3 | Al(OH)3 | |
开始沉淀pH | 7.1 | 2.2 | 4. 1 |
沉淀完全pH | 10.8 | 3.5 | ? |
Al(OH)3沉淀完全的pH为______________{已知Ksp[Al(OH)3]=1×10-33};“调pH”时,应将溶液pH调整的范围是______________________。
(4)“除重金属”时,发生反应Hg2++MnS![]() HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
(5)“步骤X”包含的操作有蒸发浓缩、__________、洗涤、干燥等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
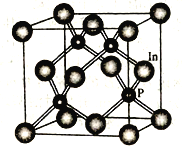
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molX和2molY充入2L密闭容器中发生如下反应:X(气)+3Y(气)![]() 2Z(气)+aQ(气)2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
2Z(气)+aQ(气)2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.8mol/L
C.Y的转化率为60%
D.反应速率v(Y)=0.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:
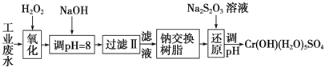
注:部分阳离子常温下沉淀时的pH见下表
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________,氧化Cr3+的目的是__________。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
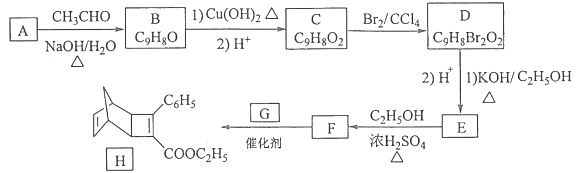
已知:①![]()
②![]()
回答下列问题:
(1)A的名称是__________。
(2)已知G为![]() ,写出由F生成H的化学方程式为__________________________。
,写出由F生成H的化学方程式为__________________________。
(3)E的结构简式为____________,其中含氧官能团的名称为_________________。
(4)由B生成C和D生成E的反应类型分别是__________、_____________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,则符合要求的X的结构简式有_______种。
(6)参考上述合成路线,写出用环戊烷和2–丁炔为原料制备化合物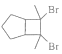 的合成路线____________________________________________________________________(其他试剂任选)。
的合成路线____________________________________________________________________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com